|
概要
作者: Jennifer Bordeaux, Allison W. Welsh, Seema Agarwal, Elizabeth Killiam, Maria T. Baquero, Jason A. Hanna, Valsamo K. Anagnostou, and David L. Rimm. 美国耶鲁大学医学院病理学系
在基础科学研究和临床化验中,抗体是最常用的工具,但没有普遍接受的准则或标准化的方法来确定这些试剂的有效性。此外,对于用于商业化的抗体,很显然标签上所示的并不一定和其真实情况想符合。 为了检测一个抗体的有效性,它必须被证明是特异性的,具有选择性的,并且在它的背景下是具有可重复性的。在这篇综述中,我们着重强调抗体工作时常见的问题,检测抗体时的常用方法,以及七家抗体供应商对于商业化抗体鉴定所采用的等级要求。最后,将会分享我们对于用于免疫组织化学和定量免疫荧光的抗体的检测标准。 引言
抗体是最常用的研究工具,常规地用于免疫印迹(WB)英文、免疫沉淀(IP)、酶联免疫吸附(ELISA)、定量免疫荧光(QIP)和免疫组织化学(IHC)。抗体还是临床操作中的重要工具,在检验医学(ELISA检测和流式细胞术)和病理解剖(IHC)方面广泛被使用。在病理解剖中,IHC作为一种诊断、预后和预测的方法,并且在临床上,IHC的数据结果直接影响对病人的治疗。例如,对乳腺癌患者采用IHC来检测雌激素受体α(ER-α)和人表皮生长因子受体2(HER2)来决定一个病人是否需要接受治疗,该项治疗每年多达100,000美元。因此,在临床以及实验室研究中,仔细准确的检测抗体试剂对正确的结果至关重要。
由于临床诊断的给出要依靠基于抗体的实验,抗体的有效性会对此产生很大影响,因此已经有许多文献报道了对类似这种检测进行标准化以及关于建立抗体鉴定标准的迫切需求。尽管许多组织表明了这种需要,但是现在仍然没有广泛接受的规范标准可应用于基于抗体的检测。现在有许多书是关于这方面的,这些书是由世界级的专家完成的,比如CliveTaylor和David Dabbs,而在最近一个专案小组发表了一系列的“建议”。然而,这些著作都是集中于研究免疫组化法的临床运用方面,常常是依据个人主观的判断标准而不利用最新的允许更加精确评价抗体的科学研究进展。相反,有一些其他组织已经利用表面等离子体共振,甚至是对结合到抗原的抗体晶体采用X射线检测来对抗体进行生物学的严格的评价,通常这些方法是在常规研究和临床上无法实现的。抗体鉴定在严密性和方法性上会有如此大的变动,很大部分原因在于对抗体鉴定上,缺乏对一种方法达成共识。在此,我们总结了目前抗体鉴定的方法以及鉴定失败的相关原因。这项工作特别关注于对甲醛固定石蜡包埋组织上的癌症相关生物标志的预示和预测进行评估。 什么是抗体鉴定?
美国食品和药物管理局定义鉴定为“通过使用特殊的实验室研究方法来完成证明的过程,确定一种分析方法的性能特点,是适合其预定的分析用途的” 。对于抗体而言,必须证明在其使用背景下具有特异性、选择性和重复性。当涉及到免疫组化实验时,由于影响甲醛固定石蜡包埋组织染色的前期分析,正式分析,及后期分析的因素众多,要做到标准化,是相当具有挑战性的。固定时间的不同、不充分的固定过程、固定剂使用的不同以及组织的处理过程都会影响组织的抗原性。抗体的克隆和稀释,抗原的检测,检测系统以及对选择的不同切断点进行解释,都是调控免疫组化检测的重要变量(V.K.A. , unpublished data) 。在此,我们重点关注分析因子,并强调适当的抗体鉴定的重要性,特别是对于免疫组化实验和定量免疫荧光实验。
抗体研究中的常见问题
非特异性抗体
一篇最新的由Michel 等发表的评论强调了针对19种G蛋白偶联受体亚型的49种抗体缺乏对靶目标的特异性,说明急需要更加严格的抗体鉴定标准。作者着重强调的例子包括缺乏毒蕈碱受体的M2和M3亚型双敲除的小鼠仍然对M2和M3受体的抗体呈现阳性染色,三α1肾上腺素能受体的三敲除小鼠亚型的染色状况与野生型小鼠类似。
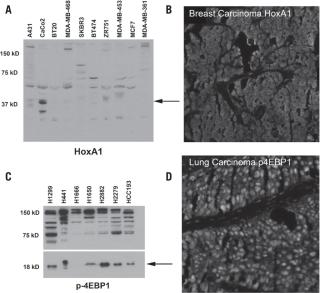
一种抗体的特异性很大程度上是依赖于抗原的:合成的多肽或纯化的蛋白。合成的多肽具有可知道其结合的氨基酸序列的优点;但这些多肽必然不能完全再现天然蛋白的3D结构或其转录后修饰过的结构。结果是由合成的多肽所产生的抗体可能不能重现其在具有完整3D结构的天然构象时的功能。这样的抗体对于IP或IHC实验而言,可能是达不到要求的,但在蛋白印迹实验中,跑SDS变性胶的完全变性的蛋白可使用这样的抗体。当然也存在相反的情况,特别是对于那些免疫原是纯化的蛋白时,这种情况下,抗体是在蛋白以天然构象存在时起作用,而不是变性之后。因此蛋白印迹实验不能作为免疫组化实验或者其他抗原是以其天然构象存在的情况下的抗体结合的绝对标准, 对于固定的组织,蛋白的天然构象与变性后的构象的选择更为复杂。在天然蛋白中没有暴露的表位会在固定化的组织中暴露出来,反之亦然,即使他们可能并不是真正的变性。因此,一种抗体可以在新鲜的组织中识别某种表位,而在组织被固定后识别另一种表位。一个具有代表性的例子是一种在BCL-2(41-54位氨基酸)上的表位,该表位在BCL-2存在于细胞质中时是暴露的,在BCL-2位于核内时是隐藏的,这极有可能是因为BCL-2与其他蛋白相互作用的原因。尽管如此,当BCL-2在靠近该表位的位点发生磷酸化时,该表位又可暴露出来,比如当蛋白从细胞中抽提出来时或者是通过SDS发生变性时。 在选择单克隆抗体还是多克隆抗体时,表位特异性问题更加复杂。多克隆抗体表示存在一个结合抗原的抗体库,相比于单克隆抗体几乎只能在一类背景下工作,抗体库可以在不同的条件下显示出更好的检测性。虽然如此,多克隆抗体中可能包含有亲和力相比之下较好的抗体克隆。其中最能说明这个的例子可能就是FDA批准的来自Dako的HercepTest抗体,该抗体是用于检测乳腺癌的HER-2的表达。多克隆抗体是由产生免疫球蛋白的融合细胞所形成的单克隆产生的,因此其纯度更好。然而这些克隆是在宿主动物的腹水中产生的;因此,这些抗体制剂中可能还含有你感兴趣的多克隆抗体以外的其他抗体。一项由Spicer 等完成的研究表明他们所分析的染色定位于高尔基体内的二十种多克隆抗体制品中,有7种抗体(35%的比例)与其抗原特异性没有联系,并且这些交叉反应抗体中有5种不能与其目标抗原染色。我们实验室中抗体鉴定工作显示同样缺乏特异性,即使是多克隆抗体也同样存在这样的情况。图1列举了两个我们实验室所测试的非特异性抗体的例子。在图1A中,采用了一种抗HoxA1(B01;Abnova,台北,台湾)小鼠多克隆抗体,通过免疫印迹的方法,来检测来自十种细胞系的裂解物。其中目标蛋白的分子量大小37KD,而CaCo2的裂解物得到了这样的条带(箭头所示)。所有的这些裂解物都显示出多条信号比较弱的大于和小于37KD的条带,而预期的情况是,如果这个抗体被检测是只抗转染了过表达载体HoxA1的细胞系的话,那就应该没有这些杂带。由免疫印迹法所得出的这种水平的干扰引起我们关注抗体的非特异性。图1B提供了一个典型的在乳腺癌组织中HoxA1抗体的染色模式。其中一种同源盒转录因子的胞质染色占据绝大部分,表明该抗体不适用于免疫组化实验或者是免疫沉淀实验。图1C给出了抗磷酸4EBP1(兔单克隆抗体,236B4号克隆;Cell Signaling Technology,Beverley, MA, USA)的多克隆抗体的例子,图中显示有目标条带和比目标条带大的其他杂带。图1D是对甲醛固定石蜡包埋的肺癌组织采用这种抗体进行免疫组化实验,可以观察到核被染色,而磷酸4EBP1本应是定位于胞质的。 非重复性抗体
大量抗体之间微弱的联系令人担忧,正如我们实验室最近的一项对抗酪氨酸激酶蛋氨酸受体抗体研究所得出的结论。严格地说,两次不同批次的3D4蛋氨酸单克隆抗体对包括688例乳腺癌组织的阵列进行染色,得到完全相反的染色结果,一次是核被染色,一次是胞质被染色,回归运算得出的两批抗体之间的R2值达到0.038。另外一个抗体非重复性的例子是由Grimsey 等人于2008年证明的,采用的是一种被认为应该是抗大麻素CB1受体的抗体。作者通过免疫印迹法和免疫荧光法,测试了多种商业化来源的抗体,该抗体抗转染了带有HA标签的CB1受体的HEK细胞。测试的六种抗体中只有两种显示出特异性的膜染色,通过与抗HA抗体的共定位来检测。此外,对HEK细胞裂解物进行免疫印迹分析表明,缺乏免疫荧光特异性的抗体检测出的结果要么是蛋白分子量大小是错误的,要么是检测不到蛋白或者是在不表达CB1受体的野生型HEK细胞中检测出蛋白。
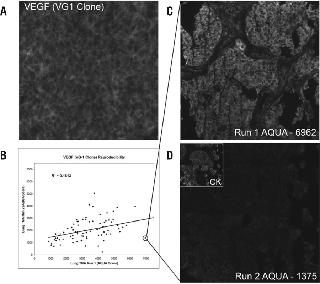
一些非重复性抗体的例子能够做到非常的精细。图2列举了两个例子,看起来似乎是在预期的位置出现特异性的染色。然而,在同样的条件下,对一系列的TMA(代表同一个病人的组织)的染色显示出极差的相关性。VEGF是一种分泌型的生长因子,因此我们预期可以对带有VG-1克隆的病人组织进行胞质染色(图2A)。采用同一批次的抗体对连续切片的同一组织微阵列进行染色,得到的结果不具有重复性,其中R2值达到0.016(图2B)。 抗体鉴定中的一般方法
抗体特异性
如果抗体识别的是变性的抗原,那么免疫印迹法就可广泛地用来鉴定一种抗体的特异性,并且适用于抗体鉴定的第一步。对于选定的靶目标而言,抗体特异性的第一个特征就是可以观察到对应于靶目标蛋白分子量的一个单一条带。多个条带的存在或者是非目标条带的出现可能代表的情况是同样的靶蛋白以不同是转录后修饰状态存在,存在不同的断裂产物或者是存在剪接变体。尽管如此,这样的结果会让我们对于把抗体用于后续实验产生担忧。Major 等人在2006年时发表了他们构建的数据库AbMiner,其中包含的信息有免疫原、抗体供货商以及超过600种商业化的可用的单克隆抗体,这些抗体已经通过对来源于NCI-60的每一种细胞系进行免疫印迹法来批量检测过。如果一种抗体能够产生一条(或者多条)对应于靶蛋白分子量的预期条带,我们就认为该抗体通过检测。
抗体特异性已经采用特别地应用于免疫组化的阻断肽来进行评价。这些多肽的序列是与产生抗体的序列相同的,通常是采用极大量的阻断肽与抗体一起孵育。之后把与阻断肽一起孵育的和没有一起孵育的抗体染色那些表达有目的靶蛋白的组织。如果抗体是特异的,那么其中所加入的阻断肽将会导致对组织的染色失败。最近发表的一篇关于抗ERα的磷酸特异性抗体的鉴定就是采用的此方法。尽管这种方法能够证明由相应抗原产生的抗体对抗原的特异性,但是它不能证明该抗体的选择性,因为抗体的非靶蛋白结合的活性将会被预先吸附的阻断肽所抑制。因此,在阻断肽存在的情况下,非特异性染色的出现能证明一种抗体不好,但他们不能证明一种抗体是好的。阻断肽已经应用于大量的抗G蛋白偶联受体的抗体,并被发现对于更严格的抗体鉴定是没有选择性的。因此,我们通常不把阻断肽作为抗体鉴定过程的一部分。 证明抗体特异性的关键常常是使用正确的对照。在免疫组化实验或者是定量免疫荧光中,不含原始抗体的一个阴性对照是可行的,但是还不够充分。更好的阴性对照是表达目的蛋白的一个细胞株或者组织。因此最好的阴性对照就是相应蛋白基因的敲除细胞株。类似地,最好的阳性对照是将目标蛋白转染到不表达该蛋白的细胞株。由于这些试剂在大部分实验室都没有,我们可以通过其他一些方法来获得可用于比较的对照结果。通常会有一些容易获得的已经通过生物学证明不表达目标蛋白的细胞株。例如,PTEN表达缺失的H165-0细胞株就可以作为抗PTEN抗体的一个很好的阴性对照。类似地,过表达的细胞株可以作为阳性对照。例如A431细胞株过表达野生型的EGFR,它就可以作为抗EGFR抗体的阳性对照。一种替代敲除细胞株的对照可以是通过siRNA或者是shRNA实现表达下调的细胞株,这个将在我们Rimm实验室的抗体鉴定规则中讨论。 最后,另外一种质量控制的玻片已经由Sompuram 等人开发出来,通过把多肽与玻片共价连接来模拟天然抗原的表位,因此可以作为一个已知单克隆抗体的特别对照。这种对照的缺点是它只能用于单克隆抗体,因为为了能够作为合适的肽对照,抗体必须和一个已知的表位相互作用。 抗体重复性
抗体鉴定和标准化的一个重要指标是抗体的重复性。这意味着随着时间的推移,不同时间不同批次的同种抗体的染色情况,以及比较新的抗体或之前确认的抗体或第二种独立的手段测定目标,会产生类似的结果。现在关于抗体重复性的研究还不是很多,因为这通常需要承担使用同种抗体的新出的批次或者是使用自己实验室之前使用的抗体的新的部分的代价。我们实验室发表了一篇关于这方面鉴定的文章。并且一项类似的关于HER2的重复性的实验已经由Gustavson和其伙伴完成。
与抗体重复性相关的另一项工作是,当一个新的试剂被使用时,我们都希望它能够和之前已经检测过的标准抗体进行比较。这方面的研究文献报道的比较多。例如,van der Vegt等人采用4B5兔单克隆抗体对283 例乳腺癌患者的组织微阵列的HER2进行免疫组化染色,把结果与之前确认的CB11小鼠单克隆抗体进行比较。另外,两种抗体也进行了相互比较,并比较了每种情况的FISH值。作者发现两种抗体在灵敏度、特异性或预测值方面存在重大差异,验证了4B5可以被用来评价HER2的表达(31)。第二个例子来自Zafrani等人,他采用了从免疫组化法到酶免疫测定法,对ER和PR的抗体进行比较,发现两种方法之间存在重要联系(32)。Sasano等人也完成了类似的研究,通过使免疫组化值与由样品分离检测决定的生化活性相联系,验证了抗芳香酶单克隆抗体的使用(33)。有的时候,这种方法被用来试图证明一种新试剂的优越性。在这些情况下,研究者必须以结果产生预期用途或者是对治疗产生反应的情况下,而不是之前的检测,来作为比较的标准。这方面做的好的是Cheang等人的工作,他们展示的ER的抗体SP-1能够比现在的标准抗体1D5具有更好的预测性,尽管之后Brock和他的同事对这个结论有争议。
商业化抗体的以供应商为标准的鉴定
据估计现在有超过180家的抗体公司,生产超过350,000种应用于研究和临床的抗体((www.antibodyresource.com/onlinecomp.html)。因此,不用奇怪大部分蛋白都具有商业化的抗体。当买一个分离DNA的试剂盒时,通常是假设它不会不纯化蛋白。然而,对于抗体而言,不是这样的情况。因为生产商声称一种抗体对蛋白Z具有特异性,并不一定意味它只结合蛋白Z而不会结合其他一些蛋白。在2005年,RamosVara指出同样靶蛋白的抗体,根据生产商的不同,差别很大。实际情况是,我们现在很清楚鉴定抗体特异性的责任是在购买者而不是供应商。不同的供应商提供不同的鉴定标准,这依赖于他们在平衡利益和高质量之间关系时所采用的生产抗体的方法。为了完成这篇综述,我们比较了来源于七家不同公司的随机挑选的分子AMPKβ1的抗体鉴定水平和信息量(在此以公司1-7简称)。因为仅仅是从超过180家的公司里面随机挑选了7家公司,所以并不能完全反应真实情况;再有,一些公司的抗体鉴定水平根据不同的产品而有所差别。当情况允许时,我们比较了磷酸特异性抗体技术数据表上的抗体鉴定方案,因为这些是需要另外一种水平的特异性和鉴定(37,38)。
一般说来,我们发现有三种水平的鉴定标准。最低水平的标准是在公司1的磷酸化AMPKβ1多克隆抗体的鉴定中发现的。在它公司的网站上不能获得相关信息或者是关于抗体鉴定的任何水平的标准。技术数据表本身就只包含了很少的信息,只有抗体使用的靶目标背景和相应的引用、推荐使用和在免疫印迹(WB)、免疫沉淀(IP)、酶联免疫吸附(ELISA)实验中的起始稀释倍数。然而任何关于成功使用了该产品的例子都没有提供,并且没有提供任何关于使用了该抗体的文献。技术数据表也提供动物宿主和多肽合成的免疫原来源,但没有告诉具体的多肽序列,尽管这些肽可以让购买者用来作为阻断肽来使用。技术数据表也警告说本抗体“可能”会和相关的磷酸化的AMPKβ2交叉反应。 公司2-5的抗体鉴定标准属于中等水平。这些公司也没有提供什么关于抗体鉴定过程的深入描述。技术数据表包含的所有信息是靶目标的背景和关于抗原的信息。四家公司中的三家提供了完整的使用序列信息,第四家确定了序列使用时磷酸化位点周围的区域。这些公司也提供了推荐应用的起始稀释倍数,并且几个公司都提供了至少一例关于抗体在按照推荐使用的其中一项建议的来操作时,成功识别其靶目标。免疫印迹法是最常用的展示抗体鉴定的例子,采用的样品,要么是使用转染过的表达靶蛋白的细胞株,要么是预先把抗体和阻断肽一起孵育。 最高水平的抗体鉴定标准是来自公司6和7.公司6描述了磷酸特异性抗体的鉴定过程,包括在多种细胞株中进行免疫印迹分析,肽和磷酸化肽的竞争实验,定点突变分析。通过对两种或者多种预先合格的单个批次进行组合来生产抗体,减少各个批次之间的差异,以此为帮助,公司6试图证明各个批次之间的稳定性。公司7描述了他们所有抗体的严格的鉴定方案,包括采用免疫印迹、免疫沉淀、免疫组化、免疫荧光、流式细胞术和酶联免疫法来检测每一个抗体。当条件允许时,该公司通过使用适当的激酶特异性激活剂或抑制剂来检测抗体的特异性和重复性,测试了表达已知目标蛋白的多种细胞株;针对磷酸特异性的采用磷酸酶处理;与异构体对照进行比较;在转染细胞、敲除细胞和siRNA处理的细胞中进行实验验证;利用阻断肽来消除所有信号;验证了正确的亚细胞定位或者诱导处理的转位;比较了新批次和以前批次的抗体;提供最佳的稀释倍数和缓冲液,以及指定了作为阳性和阴性对照的细胞株。 对于用于免疫组化的抗体,公司7对其在石蜡包埋的细胞团上进行测试,其中细胞团是来源于经过诱导信号改变处理或者是使目标蛋白表达降低的siRNA处理的细胞株。再有,磷酸酶处理的组织也用于测试甲醛固定石蜡包埋组织的磷酸特异性。移植有表达已知目标蛋白细胞或者是经过表达调整处理细胞的组织先采用石蜡固定,然后染色。 来自公司6、7的技术数据表包括了公司2-5的技术数据表中的所有内容,并额外列举了成功使用他们抗体的例子。例如,公司6的技术数据表就有针对所有鉴定过抗体所推荐使用浓度的代表性数据,并给出针对流式细胞术、免疫细胞化学的推荐使用细胞株(包括通过和磷酸化肽或者是非磷酸化肽共同孵育来证明只有和磷酸化肽一起孵育的才发生信号缺失),用于免疫组化的阳性对照组织,以及可作为免疫印迹法阳性对照的细胞裂解物,该对照也是通过采取与磷酸化肽或非磷酸化特异性肽预先孵育之后进行检测,证明只有当和磷酸特异性肽一起孵育的才会产生一条预期分子量条带,预示信号的缺失。 从公司1购买的抗体(该公司只提供了最少量的信息,并且没有给出成功使用他们产品的的例子)研究者要证明其只对感兴趣的目标蛋白起作用,将需要进行大量的鉴定,该公司基本没有提供抗体工作的任何方式的保证。公司2-5对其代表性抗体提供了较多信息和至少通过采用技术数据表其中一条建议并使用相应阳性对照情况下,成功使用抗体的例子。尽管这样明显比公司1的方式好,但是这些抗体仍然需要研究者对其特异性和不同批次的重复性进行鉴定。公司6描述了他们用来判定自己公司的磷酸特异性抗体的特异性和重复性的鉴定步骤。进一步,对其提供的每一项推荐使用,都列举了一例关于采用他们提供的阻断肽而成功使用抗体的例子。公司7提供了我们认为的抗体鉴定的黄金标准。他们介绍的自己所做的大量测试给使用者很大信心,相信在按照公司所提供的针对特别抗体的推荐使用进行操作,可以使抗体很好的发挥作用。该公司也保证采用他们的抗体,得到的结果将是特异的,并且保证各个批次之间的重复性。 然而,尽管公司6和7对抗体进行了大量的鉴定工作,但是研究者仍然有责任去确定所购买的产品在用于实验室里人们感兴趣的细胞或者是组织时,具有特异性和重复性。的确,即使是最好的公司,也不能控制他们的产品在离开公司后会怎么样。因为在运输、不恰当的保存或者是到达实验室后,使用者在操作中造成污染,这些情况都会对基于抗体的测试产生潜在的错误。因此在做每一次实验时,严格而综合性的对照是必不可少的。
Rimm实验室针对免疫组化/定量免疫荧光的抗体鉴定规则
抗体鉴定没有统一的或者是强制性的标准。不像药物,没有食品及药物管理局的批准,是禁止出售的,抗体出售到以抗体为基础分析的市场是没有官方管理的。将来,我们可能可以看到FDA针对抗体的许可证或者是对用于临床测试的试剂被更加严格的分类和管理。然而,到现在为止,仍然没有一个统一的标准。因此,我们对抗体鉴定问题,提出我们实验室的方法(Rimm实验室的规则)。我们的方法并没有被任何理事机构或者是任何同业公会所批准或核实,因此我们并不敢大胆地说它是“规则”。相反,我们提供的是我们觉得在实验严谨性和实验室经济方面相对合理的并且可以使实验结果足够可信的一种方案。我们的抗体鉴定规则(如图3所示)特别集中在对免疫组化或定量免疫荧光的石蜡包埋组织的最后使用上,但对其他以抗体为基础的检测也具有同样的效果或修饰。
我们的第一条证据是通过免疫组化实验证明一种抗体针对感兴趣的靶蛋白是特异的。我们选择了多种细胞株的裂解物(或者是组织匀浆),理想的情况知道目标蛋白的表达水平,这样阳性对照和阴性对照细胞株就可以被分析。实际上来说,我们经常是不知道目标蛋白的表达水平的,并且对于细胞株的选择也是随机的。我们通常是选择我们怀疑的某个对靶蛋白完全是不表达的细胞株(例如采用纤维原细胞来做上皮细胞含有的蛋白)。当实际的阴性对照不可性时,或者当目标蛋白的表达水平高度依赖于细胞的生长情况时,我们就使用通过RNAi下调目标蛋白表达细胞的裂解物,或者是我们对典型的不表达目标蛋白的细胞采取转染过表达载体,从而获得细胞裂解物。最近的一个例子中,我们就采用了诱导过表达的方式(A.W.W.,未发表数据)。图4列举了一个关于一种微管不稳定蛋白Stathmin(兔单克隆抗体;Epitomics, Burlingame,CA, USA )例子,其中就是使用siRNA来辅助抗体鉴定的。模拟转染的,或转染了干扰siRNA的对照,或是转染Stathmin特异性siRNA的BT-20细胞裂解物备用来进行免疫印迹分析,证明Stathmin蛋白的表达缺失(图4A)。同时也对转染了干扰siRNA或Stathmin siRNA的BT-20细胞进行固定和通过免疫荧光可视化了Stathmin的降低表达(图4B)。另外,当目标蛋白的激活子和抑制子是可用时,在鉴定抗体特异性的特殊阶段,可以采用激活子和抑制子处理过的细胞裂解物来作为对照(例如磷酸化)。只在表达目标蛋白的细胞株中才出现正确分子量大小的单一条带(或如果是由于多于一种的蛋白异构体可以和抗体相互作用而导致产生多条带),促使我们对用于免疫组化/定量免疫荧光的抗体进行进一步的鉴定。在免疫印迹法中不结合蛋白的抗体也可能是对其靶蛋白的天然构象是特异的,因此,如果抗体是用于IHC/QIF的,那么就可以通过IP实验来鉴定抗体的特异性。 针对IHC/QIF抗体鉴定的第二步是在由甲醛固定石蜡包埋细胞团组成的组织芯片上对抗体进行浓度滴定,这些细胞团是对应于之前通过免疫印迹法鉴定过的,它们是出病人组织外可以表达目标蛋白的(更多关于组织芯片的信息参看参考文献39和40)。一种好的抗体具有以下特征:(i)只染色表达目标蛋白的细胞团,(ii)当增加抗体稀释度时,染色水平下降;(iii)证明出的蛋白表达情况是和已经发表文献的生化数据时一致的。通过前两步观察得到的目标蛋白表达情况应该进行定量—我们使用ImageJ图像处理软件对免疫印迹图进行定量,采用AQUA来评估组织芯片上每一个点的蛋白表达水平—而得到的结果之间应该是具有很强的相关性的。图5提供了一个满足这些条件的抗体例子,ER-α(1D5 clone; Dako, Glostrup, Denmark)。正如文献报道的,病人乳腺组织的染色情况是主要在核内(图5A)。多种ER表达水平的乳腺细胞株(图5B)和通过免疫印迹法来分析的重组ER蛋白的标准曲线,以及对由IHC所得到的ER蛋白的表达量进行的描绘(细胞裂解物的蛋白上样量是pg/μg)和通过AQUA进行的定量都显示出两种方法得出的结果具有很强的联系(0.91的R2值)(图5C)。 对于任何使用的抗体,抗体鉴定的最后一步是证明不同实验和不同批次的抗体是具有重复性的。我们对包含有约120个点的病人组织使用不同批次的抗体染色来完成最后一步的鉴定。抗体多个批次的高度相关性是我们抗体鉴定的最后要求。抗MAP-tau(United States Biological, Swampscott, MA, USA)的抗体提供了一个这样的例子,通过AQUA定量的不同批次的抗体显示出很好的相关性(图6A)。每次抗体用于不同的病人组织时,相应地来自病人组织的对照样品会平行地染色来作为额外的染色对照。对照病人组织玻片应该在特异性和重复性方面与之前的实验保持高度的相关性。图6B显示了MENA(mouse MAb, clone 21; BD Transduction Laboratories, Franklin Lakes, NJ, USA)在相互检测时的重复性。 这些鉴定步骤相对比较快捷和省钱,但最重要地是,他们更加具有综合性。这种抗体鉴定的规则有点类似于许多其他之前文献报道过的方法。文献的作者都指出来源于缺乏抗原的敲除动物的组织是抗体鉴定的最好对照之一。当条件允许时,这种组织将会是对任何病人组织对照的极好补充,但这种情况不是对感兴趣的每一种蛋白都有效,并且对于单一目的的抗体鉴定工作,这将是一件费时又费钱的投入。理想情况下,正如最近来自Alexander Kalyuzhny的预见,将来某一天我们将会有抗体生产和使用的标准,那时所有的公司将以高标准来进行抗体鉴定,而研究者将对他们所提供的产品更加有信心,临床上的收入将不会再浪费在错误标记的“PBS瓶”上。然而,目前的情况是抗体特异性和重复性的鉴定工作最终是落在研究者或者是实验室管理者身上。
致谢
感谢威斯康辛大学的 Elaine Alarid所提供的诱导表达ER-α的细胞株。该项工作是由国立卫生研究所(NIH; grant nos. CA139431, CA 114277, CA 110511,and CA 106709, to D.L.R.);Susan G. Komen基金会 (grant no. KG090562,to D.L.R.);和国防部乳腺癌研究项目[grant nos. 1W81XWH-06-1-0746 (to M.T.B.), 1W81XWH-08-1-0404 (to J.B.), and 1W81XWH-08-1-0784 (to A.W.W.)]支持的。本文美国NIH公共获取政策。
利益竞争
作者声明无利益竞争存在。
图1. 抗HoxA1和磷酸4EBP1抗体的非特异性例子
(A)细胞裂解物经过变性、SDS PAGE胶分离后,被转到硝酸纤维膜上,再用抗HoxA1的小鼠多克隆抗体来免疫吸附。CaCo2细胞裂解物能看到预期分子量大小的一条带(由箭头指出)。注意在所有细胞株中出现的多条杂带。(B)典型的例子:对甲醛固定石蜡包埋的乳腺癌组织进行抗HoxA1的免疫组化染色。注意一种核转录因子的胞质染色情况。(C)磷酸化EBP1的免疫印迹法。箭头指示出预期分子量大小的条带;再有,所有的裂解物都显示出多条非预期的条带。(D)典型的例子:对肺癌组织进行抗磷酸化EBP1的免疫组化染色。注意对于一种预期定位于胞质和核内的蛋白,出现了以核定位为主导的染色情况。 图2.VEGF CG-1克隆的抗体缺乏重复性
(A)采用VG-1(1:50稀释)对甲醛固定石蜡包埋的组织进行免疫组化染色,得到预期定位的特异性染色。(B)对病人肺组织的连续切片进行VG-1(1:50稀释)染色,发现相互之间并不相关。(C,D)对同一病人组织连续切片的VEGF免疫组化染色,第一次显示的高水平的阳性结果(图C),而第二次却呈现出阴性结果(图D)。 图3.Rimm实验室针对用于IHC/QIF抗体所采用的抗体鉴定规则

抗体鉴定的第一步是在体外采用细胞株来测试抗体特异性。第二步(虚线下面的部分)进一步采用病人组织微点阵来对不同实验操作和抗体批次进行目标蛋白的定位和重复性的鉴定 图4.siRNA下调Stathmin的表达

(A)经过24小时模拟转染后BT-20裂解物的免疫组化,对照的干扰siRNA或者Stathmin siRNA的转染证明Stathmin的表达水平下降。GAPDH作为上样量的内参。 (B)BT-20细胞在转染了干扰siRNA或者Stathmin siRNA 24小时后固定于4%的PFA,Stathmin的免疫沉淀实验证明Stathmin的表达水平有所下降。 图5.ER-α的抗体1D5证明WB和IHC之间有很强的联系

(A)甲醛固定石蜡包埋的MCF7细胞的1D5(1:50稀释)染色证明了预期的ER-α在核的定位。(B)采用1D5对一板乳腺癌细胞进行免疫印迹实验,证明ER-α的表达量是不同的。Puro细胞株是能稳定表达可诱导ER-α的MCF7细胞。β球蛋白是作为上样量的内参。(C)由免疫印迹实验得到的ER-α的表达情况通过使用ImageJ图像处理软件的处理来进行定量,联系到相应的细胞裂解物的AQUA分数,我们证明了其中有很强的联系。 图6.实验重复和抗体批次不同的情况下,抗体具有重复性
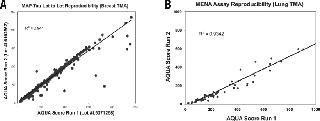
(A)对病人乳房组织的压模使用MAP-tau多克隆抗体,显示了不同批次抗体的可重复性。(B)对病人肺组织连续切片染色时,MENA的R2值可以达到0.932,证明采用同样批次和稀释度的抗体在不同时间不同实验中都具有高的重复性 参考文献
|
