关于鉴定成体干细胞和胚胎干细胞的细胞标记物的全面综述。
A comprehensive review of cell markers for identifying adult stem cells and embryonic stem cells.
干细胞标记物是基因和蛋白产物,他们被科学家用来分离和鉴定干细胞。此外,干细胞也可以功能分析进行鉴定,功能分析被认为是鉴定和治疗的黄金标准。虽然,功能分析是确定干细胞的理想方法,但是它们的分子标记物只能提供系统化的方式来体现健康,稳健的干细胞群的特征。由于干细胞鉴定的及其复杂性,特异性,有效性和和缺乏特异性分子标记,关于其在治疗应用上的知识是非常有限的。此外,干细胞群的标记物特征经常随着起源,物种,所谓的多能性(全能型和多能性)而波动。尽管关于标记功能的知识有限,其独特的表达方式和时序为我们提供了有用的工具用来识别和分离干细胞。本综述探讨了在基于细胞的再生医学的关键应用中的,用于鉴定/分离和表征成体和胚胎干细胞的一些标记物系统。
胚胎干细胞(ES细胞)是从一种早期阶段胚胎-囊胚的内细胞团分离出的多能干细胞 [1] ES细胞具有高潜能去分化成多种细胞类型 [2] 。 换言之,多能性,哺乳动物发育的基础,被赋有巨大潜力去启动和发育几乎所有谱系的成熟生物体(除了那些形成胎盘或胚胎的) [3] 。 未分化的胚胎干细胞(ES)和诱导多能干细胞(iPS)可以通过功能定义,功能是分化成来自外胚层,中胚层和内胚层的细胞并且在较晚的时间能形成所有类型细胞的能力。胚胎干细胞具有两种不同的性质,这使得它们对细胞治疗富有吸引力。首先,如胚胎干细胞来自于早期囊胚(一个非常早期的发育阶段),它保持非凡可塑性,能分化成构成人体大约200细胞类型的任何类型细胞 [4] 。 基于信号的适当组合,胚胎干细胞将发育为成熟细胞,可以作为神经细胞,肌肉,骨骼,血液或其他需要的细胞类型。胚胎干细胞的另一个重要特点是其能保持未分化状态和无限分裂的能力。这些所谓的自我更新的细胞形成了无限明确定义,在基因和基因组上特征相同的干细胞。 [4] 。 尽管我们对他们的巨大潜力有越来越多的认知,我们被限制在基于治疗途径的ES细胞的开发上。一个具有挑战性的任务是,鉴定ESC标记物也标记肿瘤干细胞 [5] 。 因此,研究人员面临着从特别是TSCs(肿瘤胚胎细胞)中分离ESCs(胚胎干细胞)的艰巨挑战。另一个潜在的问题是,忽略它们的胚发生起源,人类和小鼠在多能性的机制上也是不同的。
两个同源域转录因子,Oct4和Nanog,是第一个被鉴定出来的,在ES细胞早期胚胎发育和多能性维持所必需的蛋白 [6] 。 新兴的研究表明,除了Oct4,Sox2和Nanog,多能性所需的许多其它因子已被确定,包括Sall4,DAX1,Essrb,TBX3,TCL1,Rif1,Nac1和Zfp281 [7] 。 这些多能性因子在胚胎干细胞中形成一个复杂的转录调控网络来同时调控 [8] 。
TRA-1-60和TRA-1-81是人胚胎性癌(EC)细胞和人多能干细胞表面的抗原,这被广泛地用作鉴定和分离ESCs标志物 [9, 10] 。 此外,它们也经常用于评估诱导多能干细胞(iPS)的多能性状态。它们也在畸胎瘤和EG细胞中表达 [11, 12] 。 在分化时,视黄酸处理人胚胎干细胞,TRA-1-60和SSEA4表达水平随着时间降低, SSEA1表达水平随时间增加 [12] 。 此外,他们还表达CD349/ frizzled-9,阶段特异性抗原 (SSEA)-4,OCT-4,Nanog和nestin。Oct-4和Nanog,以及一些细胞表面标记物(SSEA-1,SSEA-4,TRA-1-60,TRA1-81)已被用于表征小鼠和人胚胎干细胞(ESC) [13] 。
| 人 | 小鼠 | ||||
|---|---|---|---|---|---|
| ESC | EGC | ECC | ESC | EGC | |
| SSEA-1 | + | - | + | + | |
| SSEA-4 | + | + | + | ||
| TRA-1-60 | + | + | + | ||
| TRA-1-81 | + | + | + | ||
| AP | + | + | + | + | + |
| Fzd 1-10 | + | + | |||
| TDGF-1 | + | + | + | ||
ESC-胚胎干细胞; EGC-胚胎生殖细胞; ECC-胚胎癌细胞。
以往,用于作为mESCs,小鼠胚胎癌(ECS),或人EC细胞的标记物,被利鉴定未分化的人胚胎干细胞(hESCs) [9, 10] 。 在植入前阶段,小鼠胚胎,人类生殖细胞,和畸胎癌干细胞的膜表面表达被称为阶段特异性胚胎抗原(SSEA)的某些分子受体 [14] 。 现在人们普遍认识到,SSEAs,鞘脂,被认为在识别具有多能和胚胎细胞表征的细胞中扮演者重要的作用。在卵子发生和胚胎形成期间,SSEA-3和SSEA-4在未分化的灵长类ESC,人胚胎生殖(EG)细胞,人畸胎癌干细胞,和ESC中表达 [15] 。 目前,阶段特异性胚胎抗原-3(SSEA-3)和SSEA-4已被用来表征未分化的hESCs,而不是未分化mESCs [16, 17] 。
Frizzled蛋白家族在小鼠和人类ESC中表达 [16, 17] 。Wnt信号通过将Fzd家族结合到Fzd和共受体-LRP5/LPR6来执行其功能,并最终激活的Wnt/β-catenin通路。Cripto-1对于早期胚胎发育起到关键的作用,并与小鼠和人ES细胞的未分化状态相关联。在发育过程中,Cripto是TGF-β配体,包括GDF1和GDF3的受体 [18, 19] 。 除了在胚胎形成期间具有至关重要的功能,作为一种致癌基因,Cripto在肿瘤中是上调的,并能促进肿瘤发生 [18, 19] 。 FFrizzled(FZD)蛋白包含由Wnt配体激活的跨膜受体(FZD1-10)家族。FZD9可以通过经典途径被Wnt 2和Wnt 8激活,通过非经典途径被Wnt 7激活。小鼠FZD9存在于发育中的大脑,发育中的神经管的神经前体细胞,和肌节。
转录因子在多能性维持中的重要本意义,可以清楚地以以下事实说明,通过诱导转录因子的表达,可以从小鼠胚胎成纤维细胞中获得多能干细胞。除了外在因素的影响,ES细胞的多能性也取决于内在因素,如POU转录因子的表达。因此,这些诱导的多能干细胞(iPS)是通过过表达一组特定的基因Oct4, c-Myc, Sox2, and Klf4来获得的。高丰度的Oct4,Sox2和Klf4使成纤维细重编程成具有多能状态的iPS细胞 [20, 21] 。任一Klf4或c-Myc与Oct4的组合足以从NSC产生iPS细胞。Oct3/ 4在多能干细胞中特异性表达。Sox家族基因与多能和单能干细胞相关。SOX1诱导iPS细胞效率与Sox2和SOX3相似,Sox 15 和Sox 18的效率有所下降。KLF5与Oct3/ 4和Nanog的转录,ESCs更新和多能性维持有关 [22] 。 Klf4和KLF2能调节某些转录因子的表达:Nanog,Tcl1,Esrrb,Sall4,Tcf3,Mycn和Fbxo15 [23] 。 Nanog是一种转录因子,并在小鼠和人ESCs的多能性和自我更新的维持中起着重要的作用,在ESC 分化时表达下调,这是与多能干细胞特性的紧密结合是一致的 [23] 。 NNanog与多能ES和EG细胞,小鼠和人EC细胞有关。
主要来说,完全重编程的人iPS细胞,与过渡期或不完全重编程的细胞相比,具有以下重要特点:(i)CD13表达下调,一种成纤维细胞标记物,(ⅱ)SSEA-4和 TRA-1-60表达上调,和其他多能性的标记物一样,(ⅲ)病毒转基因沉默,(ⅳ)Nanog内源性表达,(v)具有低Hoeschst截留能力或高Hoechst泵出潜力。完全分化的iPSCs的表达模式非常类似于正常或天然多能干细胞ESCs。例如,类似于在hESC中的表达模式,人类iPSCs也表达SSEA-3,SSEA-4,TRA-1-60,TRA-1-81,TRA-2-49 / 6E和Nanog。在基因表达和全基因组水平上,H3K4me3和H3K27me3与ES和iPS细胞极为相似。
在小鼠中,iPCs表达在未分化的ESCs表达的基因,包括Oct-3/4, Sox2, Nanog, GDF3, REX1, FGF4, ESG1, DPPA2, DPPA4, 和 hTERT。与mESCs类似,小鼠iPCs细胞不表达SSEA-3和SSEA-4,但都正常表达SSEA-1。
原始生殖细胞的前体细胞由E6.25期近端外胚层的4-8细胞发育而来,并表达转录抑制子Blimp1 [24] 。过些时间,这些Blimp1阳性细胞连续增殖并在E7.5期开始表达Fragilis和Stella [25] 。

PGCs最终引起E12.5期生殖嵴更多细胞的迁移和集群 [26, 27] 。 遗传和表观遗传协调发生的事件诱导PGC/生殖细胞形成雄性或雌性生殖细胞 [25, 27] 。 报告指出,ES细胞中的Blimp1, Stella, Fragilis, Piwil2, Dazl 和 MVH的表达, [25, 28], 说明ES细胞的起源可能是生殖细胞系。根据不同的阶段,某些标记物如Oct4,C-Kit在早期表达并在成熟生殖细胞系特化阶段前表达下调。如该示意图1,Tekt1和GDF9标记物仅在后期阶段被诱导表达。Nanos与从囊胚到成熟精子或卵细胞的所有发育阶段有关。
外胚层是非常早期胚胎的三个主要胚细胞层中的一个。其他两个层是中胚层(中间层)和内胚层(最近端层),外胚层作为最外部(或远端)层。某些因子标记外胚层,这包括Otx2, Chordin, p63/TP73L, FGF-8, Pax2. FoxJ3, Pax6, GBX2, SOX1, Nestin, beta- Tubulin, 和 Noggin。
内胚层的形成依赖由成熟或未剪切的Nodal分别激活的Cripto和Bmp4/ Wnt3介导的两个连续的正反馈回路,维持Nodal信号从着床到原肠胚形成 [29] 。
目前为止,除了我们讨论的,还有其他几种可用来进行干细胞鉴定和/或分离的标记物。这些包括基于酶(碱性磷酸酶和端粒酶)的反应,小分子(凝集素或短肽),和量子点(QD)或荧光染料等。这些标记物系统的详细介绍不在本篇综述的讨论范围内。
造血干细胞(HSCs)是唯一,多能,自我更新的祖细胞,其负责连续供应骨髓和淋巴系的已分化的血细胞类型。这些细胞包括免疫系统的淋巴细胞,粒细胞,以及巨噬细胞,以及循环红细胞和血小板。HSCs具有两种重要的能力:(ⅰ)多能性-形成所有分化血细胞的能力,和(ii)长期自我更新-产生与祖先相同的子细胞的能力。HSC优先自我更新,这使HSC从多能祖细胞中被分离出,并负责在实验模型中能成功二次移植。使用造血干细胞(HSCs)的一个主要挑战是从较大的细胞库中鉴定和分离出来它们,是因为HSCs非常稀少,骨髓细胞的1/10,000,血液细胞的1/100,000 [30] 。 形态学分析表明,HSCs在形态上类似于白血细胞。因此,ell表面标记物和分化抗原决定簇通常用来表征HSC的亚群。这也是一个公认的事实是,在成人骨髓中的HSC细胞表面标记物依据细胞周期状态和分化行为来进行动力学调节。
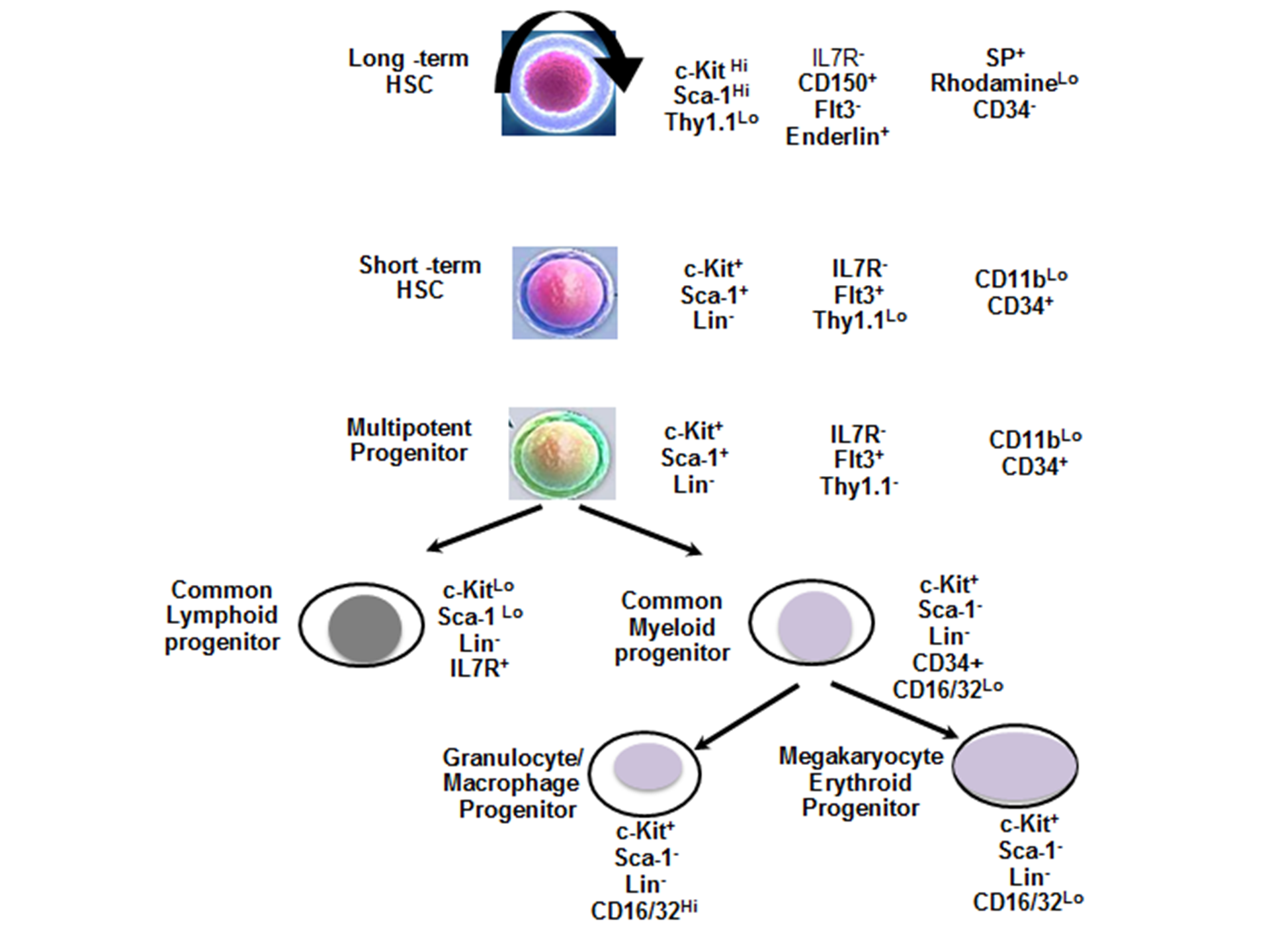
- LT-HSC : CD34-, CD38-, SCA-1+, Thy1.1+/lo, C-kit+, lin-, CD135-, Slamf1/CD150+
- ST-HSC : CD34+, CD38+, SCA-1+, Thy1.1+/lo, C-kit+, lin-, CD135-, Slamf1/CD150+, Mac-1 (CD11b)lo
- Early MPP : CD34+, SCA-1+, Thy1.1-, C-kit+, lin-, CD135+, Slamf1/CD150-, Mac-1 (CD11b)lo, CD4lo
- Late MPP : CD34+, SCA-1+, Thy1.1-, C-kit+, lin-, CD135high, Slamf1/CD150-, Mac-1 (CD11b)lo, CD4lo
造血干细胞(HSC)可以分化成的两个主要的谱系,淋巴和骨髓系。常见淋巴祖细胞可以分化为所有淋巴系 [32] 。 在淋巴细胞生成的过程中,淋巴系形成B细胞,T细胞,天然杀伤(NK)细胞,和树突状细胞。许多这些淋巴细胞生命是短暂的,并且免疫系统的稳态需要不断的HSC 自我更新和分化。这些标记物, c-KitLo, Sca-1 Lo, Lin- 和 IL7R+ 被用来表征淋巴系细胞。
常见的髓系祖细胞更能分化为祖细胞,其分别可以分化成粒细胞/巨噬细胞和巨核细胞/红细胞谱系 [33] 。 在骨髓细胞生成的过程中,骨髓系发育成粒细胞,单核细胞,巨核细胞和树突状细胞。循环红细胞和血小板也从骨髓祖细胞发育而来。
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| CD48 | P09326 | 962 | ||
| CD150 | Q13291 | 6504 | 3 | eBioscience (1), BioLegend (1), BD Biosciences (1) |
| CD244 | Q9BZW8 | 51744 | 1 | eBioscience (1) |
| CD34 | P28906 | 947 | 72 | BD Biosciences (25), Dako (15), Beckman Coulter (8) |
| CD38 | P28907 | 952 | 17 | BD Biosciences (12), Life Technologies Corporation (2), ImmunoTools (1) |
| SCA-1 | P42574 | 836 | 56 | Cell Signaling Technology (20), BD Biosciences (12), R and D Systems (5) |
| Thy1.1 | P04216 | 7070 | 16 | BD Biosciences (9), Beckman Coulter (2), EMD Millipore (2) |
| C-kit | P10721 | 3815 | 33 | BD Biosciences (9), Dako (7), Santa Cruz Biotechnology (6) |
| lin | Q9H9Z2 | 79727 | 1 | Proteintech Group (1) |
| CD135 | P36888 | 2322 | ||
| Slamf1/CD150 | Q13291 | 6504 | 3 | eBioscience (1), BioLegend (1), BD Biosciences (1) |
| Mac-1 (CD11b) | P11215 | 3684 | ||
| CD4 | P01730 | 920 | 110 | BD Biosciences (64), Dako (9), eBioscience (7) |
日益明显的是,细胞表面标记物系统耦合FACS,是用于CSC分离和功能开发的最常用的方法。
不同的组织起源的肿瘤干细胞表面表达某些受体,即CD44,CD133,CD24,CD90,CD271,CD49f和CD13。在这些中,CD44,一种跨膜糖蛋白,是突出标记物之一,并已用于鉴定各种实体肿瘤的肿瘤干细胞。例如,正常膀胱上皮的基底细胞表达CD44,这正被用作标记用于膀胱的CSCs [34]. 同样,CD44以被证实与乳腺 [35, 36], 膀胱 [34], 胰腺 [37], 胃 [38], 前列腺 [39], 头颈部 [40], 结肠癌 [41], 卵巢 [42] 的CSCs有关。 在结肠癌,敲除CD44削弱了其移植能力和直肠CSCs的体外克隆形成 [43, 44] 。 CXCR4现在正在使用在许多CSC模型中,包括胰腺癌模型。在这方面,只有CD133+ CXCR4+ CSCS可以形成远处转移,这暗示了CXCR4在癌细胞转移过程中有作用 [45].
| 癌组织起源 | 细胞表面标记物 | 参考文献 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| CD44 | CD133 | CD24 | CD34 | CD38 | CD90 | CD117 | CXCR4 | SP | ||
| 胸 | O | D | [35] | |||||||
| 脑 | O | [46, 47] | ||||||||
| 结肠 | O | [48] | ||||||||
| 肺 | O | [49] | ||||||||
| 卵巢 | O | O | [42] | |||||||
| 前列腺 | O | O | [50] | |||||||
| 前列腺 | O | O | O | [50] | ||||||
| 胰腺 | O | [51] | ||||||||
| 鳞状细胞 | O | [40, 52] | ||||||||
| 膀胱 | O | [34] | ||||||||
| 成神经管细胞瘤 | O | D | [53] | |||||||
细胞角蛋白,中间丝,可以作为细胞分化不同阶段的上皮细胞的标记物系统。这些细胞角蛋白的表达依赖于上皮的类型,并且在正常上皮细胞的分化过程中它们的表达也会变化 [54] 。 然而,细胞角蛋白是一类细胞内蛋白质,这不能通过用于CSCs分离的FACS检测。尽管有此限制,细胞角蛋白标记物可以提供宝贵的支持证据与标准标记物系统相结合,用来在实体瘤中分离干细胞,祖细胞和分化细胞 [40] 。 其中最充分表征细胞角蛋白表达模式的是在皮肤,其中CK15表达仅限于隆起区域的多能干细胞,但被CK5代替 [55] 。 分化进行中,CK5被CK10替换,最终被终端分化标记物外皮蛋白所替代 [40, 52] 。 现在可以理解的是CK14和CK5在泌尿道上皮基底细胞表达,CK8和CK18标志中间状态细胞,CK20仅在终末分化细胞中表示 [34] 。
不仅用于肿瘤干细胞(CSCs)分离的细胞表面标记物得到普及,其他标记物也通常用于分离的CSCs。侧群细胞(SP)的区分实验就是鉴定某些CSCs。已知的是,SP分析依赖于具有ATP结合盒(ABC)家族的转运蛋白的独特功能的细胞亚群。该ABC通讯系统可以迅速外排染料Hoschst 33342,则形成该SP表型。SP群落得到富集并在很大程度上与CSCs重叠,已在许多癌症中鉴定出,如前列腺癌 [56], 膀胱癌 [55], 乳腺癌 [57], 肺癌 [38] 。乙醛脱氢酶(ALDH)方法被用于鉴定干细胞和CSCs [58] 。鉴于正常和肿瘤干细胞都表达ALDH1,这种表达模式是表示乳腺癌患者的不良临床结果 [59] 。ALDH标记物系统被利用来在胶质母细胞瘤,肺癌,肝癌和其他一些癌症中分离具有CSC性质的肿瘤细胞 [59, 60] 。
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| CD44 | P16070 | 960 | 41 | BD Biosciences (12), eBioscience (4), Beckman Coulter (4) |
| CD133 | O43490 | 8842 | 17 | Miltenyi Biotec (7), BD Biosciences (3), Beckman Coulter (2) |
| CD24 | P25063 | 100133941 | 10 | BD Biosciences (5), Thermo Scientific Pierce Products (3), eBioscience (1) |
| CD90 | P04216 | 7070 | 16 | BD Biosciences (9), Beckman Coulter (2), EMD Millipore (2) |
| CD271 | P08138 | 4804 | 13 | EMD Millipore (3), Promega (3), Santa Cruz Biotechnology (1) |
| CD49f | P23229 | 3655 | 13 | EMD Millipore (5), BD Biosciences (3), Beckman Coulter (2) |
| CD13 | P15144 | 290 | 10 | BD Biosciences (5), Beckman Coulter (2), Life Technologies Corporation (1) |
| CK5 | P13647 | 3852 | 15 | Dako (5), BD Biosciences (2), Leica Biosystems (2) |
| CK10 | P13645 | 3858 | 8 | Dako (3), Covance (2), Novus Biologicals (1) |
| CK15 | P19012 | 3866 | 1 | Covance (1) |
| CK8 | P05787 | 3856 | 12 | Developmental Studies Hybridoma Bank (3), BD Biosciences (3), Dako (2) |
| CK18 | P05783 | 3875 | 19 | Sigma-Aldrich (6), Thermo Scientific Pierce Products (2), Life Technologies Corporation (2) |
| CK14 | P02533 | 3861 | 16 | Covance (5), Leica Biosystems (4), EMD Millipore (2) |
| ALDH1 | P00352 | 216 | 3 | Epitomics (1), BD Biosciences (1), Individual Researcher (1) |
骨稳态的动态过程依赖于成骨细胞的沉积和骨细胞的吸收的平衡。成骨不仅负责骨组织不断重塑,而且对骨骼的大小,形状和完整性的维持至关重要。骨稳态的破坏伴随着一些病症,包括骨质疏松症,关节炎,和许多可遗传的骨骼疾病。细胞类型特异性标志物的开发是为了鉴定已分化成骨母细胞,成骨细胞,或骨细胞的间质干细胞。某些骨母细胞可以通过TGF-β,bFGF,BMP-2,和bFGF7860771|] 或gremlin 1 [62] 的表达模式来区分。 此外,某些标记物像ALPP,MCAM,collagen I, collagen I alpha 1, collagen II, RUNX2, decorin, TPO 也可以使用。
成骨细胞是构成骨外基质的骨骼肌细胞,特异地出现在胚胎期。转录因子Runx2,在未成熟的成骨细胞中表达上调,但在成熟的成骨细胞中表达下调。研究报告称,由Runx2确定的成骨细胞系,然而Sp7和经典Wnt信号传导是下调的,这决定了间充质细胞到成骨细胞的命运 [63] 。Runx2触发了在成骨细胞分化的早期阶段的主要骨基质基因的表达,但Runx2对于成熟成骨细胞中这些基因的表达的维持不是必要的。一些相关因子也可作为成骨细胞标记物:碱性磷酸酶/ ALPP/ ALPI,骨钙素,BAP1,OPN,BAP31,osterix/ Sp7,I型胶原,SCUBE3,纤连蛋白,SPARC,和IGFBP-3 [64, 65] 。
骨细胞是骨中最丰富的细胞,微损伤引起的死亡是破骨细胞骨吸收启动的一个主要的原因。由于骨细胞分泌多种因子:TGF beta, RANKL, 和 MCSF,这可能会影响破骨细胞在被释放到髓间后的的招募功能 [66] 。骨细胞产生硬化素,并与Wnt信号相互作用,从而抑制骨的形成 [67] 。骨细胞也会产生DKK,作用于Wnt信号通路,抑制骨形成。
肌细胞生成是在胚胎期,当肌肉干细胞或成肌细胞增殖成多核肌小管时,肌肉组织的形成。在成年组织,肌肉衍生的干细胞是肌卫星细胞的一个独特群落,这促进损伤和疾病时肌肉的再生。在FGF和其他生长因子的存在下,成肌细胞增殖但不分化。缺失生长因子后,成肌细胞停止分裂并分泌纤连蛋白到细胞外基质,这促进了肌肉细胞融合的后续阶段。一种鸡尾酒标记物,包括肌原细胞标记物CD56,内皮细胞标记物UEA-1受体(UEA-1R),和血管周围细胞标记CD146,可以用来作为肌原前体标记物 [68] 。分离和鉴定分化的平滑肌(VE-钙粘蛋白,α-平滑肌肌动蛋白),骨骼肌(FABP3,整合素α7),以及心肌(结蛋白,肌球蛋白重链)需要肌细胞生成的标记物。那些肌原标记物还是肌肉癌,退行性肌肉疾病和营养不良检测的重要工具。
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| CD56 | P13591 | 4684 | 51 | BD Biosciences (20), Leica Biosystems (4), Dako (4) |
| CD146 | P43121 | 4162 | 4 | Enzo Life Sciences (1), EMD Millipore (1), Santa Cruz Biotechnology (1) |
| VE-Cadherin | P33151 | 1003 | 16 | BD Biosciences (4), Santa Cruz Biotechnology (3), EMD Millipore (3) |
| alpha-smooth muscle actin | P12814 | 87 | 7 | Sigma-Aldrich (6), EMD Millipore (1) |
| FABP3 | P05413 | 2170 | ||
| Integrin alpha 7 | Q13683 | 3679 | 1 | Novus Biologicals (1) |
| Desmin | P17661 | 1674 | 18 | Dako (12), Epitomics (3), Life Technologies Corporation (1) |
| Myosin Heavy Chain | P35579 | 4627 | 1 | |
| UEA-1 receptor (UEA-1R) |
神经干细胞(NSCs)是具有自我更新,多潜能的独特细胞,负责形成神经系统的主要表型。神经干细胞具有独特的潜力,产生一旦分化就可形成克隆相关的子代;构成由神经元,星形胶质细胞,少突胶质细胞和室管膜细胞发育成的中枢神经系统。许多神经细胞类型的鉴定和分离使用细胞表面标记物的表达。CD133在 NSC的表面表达,并已广泛用于从人脑分离NSC [69] 。CD15,胚胎特定阶段抗原-1,现在确定为小鼠室管膜下层(SVZ)的NSC和放射状胶质细胞的标记物 [70]. 。CD24被用作标记富集的NSCs [71, 72]. Peh等利用CD133,CD15和GCTM-2的组合,去从神经诱导培养物中富集神经球形成了 的NSC [72] 。Golebiewska等以CD133 + / CD45- / CD34-标记物系统从分化的hESC中分离NSC [73] 。Nestin和SOX-2作为有效的标记物,在中枢神经系统(CNS)的干细胞中表达显著,并参与神经干细胞的增殖和分化。除了细胞内分子,可用来研究的也表达在细胞表面,包括ABCG2,FGF R4和Frizzled-9。
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| CD133 | O43490 | 8842 | 17 | Miltenyi Biotec (7), BD Biosciences (3), Beckman Coulter (2) |
| CD15 | P22083 | 2526 | 15 | Dako (7), BD Biosciences (4), Beckman Coulter (2) |
| CD24 | P25063 | 100133941 | 10 | BD Biosciences (5), Thermo Scientific Pierce Products (3), eBioscience (1) |
| GCTM-2 | O00592 | 5420 | 2 | Individual Researcher (2) |
| CD45 | P08575 | 5788 | 115 | BD Biosciences (58), Dako (22), Beckman Coulter (9) |
| CD34 | P28906 | 947 | 72 | BD Biosciences (25), Dako (15), Beckman Coulter (8) |
| Nestin | P48681 | 10763 | 21 | EMD Millipore (6), Developmental Studies Hybridoma Bank (6), BD Biosciences (4) |
| Sox-2 | P48431 | 6657 | 7 | Santa Cruz Biotechnology (4), EMD Millipore (2) |
| ABCG2 | Q9UNQ0 | 9429 | 5 | EMD Millipore (1), Enzo Life Sciences (1), eBioscience (1) |
| FGF R4 | P22455 | 2264 | 1 | |
| Frizzled-9 | O00144 | 8326 |
间质干细胞(MSCs)是多能中胚层衍生的祖细胞,其能分化成脂肪,骨,软骨和肌肉组织,这提供范围广泛的治疗途径。成人间质干细胞可以从骨髓的基质中分离出来。MSCs表达一组主要的标记物,包括CD10,CD13,CD73,CD105和CD271。其他标记物包括CD140b,HER-2 / erbB2(CD340),frizzled-9(CD349) [13] 。MSC从骨髓(BMMSCs)衍生来,是能够自我更新和分化成成骨细胞,软骨细胞,脂肪细胞和神经细胞的产后干细胞。研究报告指出,BMMSCs可表达重要因子:STRO-1,CD29,CD73,CD90,CD105,CD146,Oct4,和SSEA4。然而,BMMSCs不表达造血细胞标记物,尤其是CD14和CD34 [74].
多能皮肤干细胞或表皮干细胞,在正常细胞的新陈代谢和伤口愈合期间,负责组织稳态。这种皮肤干细胞被发现驻留在毛囊内的适当位置。虽然,主要处在静止或慢细胞周期状态下,表皮干细胞是可以被刺激增殖和分化成能在伤口愈合过程中组成毛囊的专门细胞。K15蛋白的表达不仅标志表皮干细胞或祖细胞亚群,并标志表皮分化中的基底样细胞 [75] 。最近研究表明,一些蛋白表达可以用来鉴定表皮干细胞,这包括CD34, Nestin, Follistatin, p63, Integrin alpha 6, Tenascin C, Frizzled因子 [76] 因子。此外,还有其他几个关键蛋白P63,EGFR,IGFR,DELTA1,TBRII [77] 。
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| K15 | P19012 | 3866 | 1 | Covance (1) |
| CD34 | P28906 | 947 | 72 | BD Biosciences (25), Dako (15), Beckman Coulter (8) |
| Nestin | P48681 | 10763 | 21 | EMD Millipore (6), Developmental Studies Hybridoma Bank (6), BD Biosciences (4) |
| Follistatin | P19883 | 10468 | 2 | R and D Systems (2) |
| p63 | Q9H3D4 | 8626 | 17 | Santa Cruz Biotechnology (6), Thermo Scientific Pierce Products (3), Dako (3) |
| Integrin alpha 6 | P23229 | 3655 | 13 | EMD Millipore (5), BD Biosciences (3), Beckman Coulter (2) |
| Tenascin C | P24821 | 3371 | 10 | EMD Millipore (3), R and D Systems (1), Immuno-Biological Laboratories (1) |
| EGFR | P00533 | 1956 | 58 | Life Technologies Corporation (12), EMD Millipore (9), Santa Cruz Biotechnology (8) |
| IGFR | P08069 | 3480 | 10 | Santa Cruz Biotechnology (3), EMD Millipore (2), Dako (2) |
| Delta1 | O00548 | 28514 | 1 | Santa Cruz Biotechnology (1) |
| TBRII | P37173 | 7048 | 8 | Santa Cruz Biotechnology (7), Vector Laboratories (1) |
| Frizzled factors |
脂肪组织主要由脂肪细胞组成,这些细胞以形成脂滴来存储能量。此外,多能祖细胞,称为脂肪干细胞,可以由表达的标记物从脂肪组织中鉴定出来,标记物包括:整合素家庭,CD44和ICAM-1 / CD54。像间质干细胞,多能脂肪来源干细胞已经显示出在体外可分化成中胚层谱系,包括脂肪细胞,软骨细胞,成骨细胞,破骨细胞和成肌细胞。其他体外研究表明,脂肪干细胞具有额外的可塑性,并可转分化成其他胚层细胞,比如肝细胞和神经元样细胞。通常,脂肪来干细胞标记物(ASCs)是独特的粘附和受体分子,表面酶,细胞外基质和细胞骨架蛋白,和基质细胞表型相关蛋白。报告表明,ASCs的表面表型类似于骨髓来源的间充干细胞或基质细胞(MSCs) [78] ,和骨骼肌来源的细胞。不过,唯一的例外可能是糖蛋白CD34,在人类ASCs存在,但不存在于MSCs。
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| CD44 | P16070 | 960 | 41 | BD Biosciences (12), eBioscience (4), Beckman Coulter (4) |
| ICAM-1/CD54 | P05362 | 3383 | 19 | BD Biosciences (4), Beckman Coulter (3), Life Technologies Corporation (2) |
| CD34 | P28906 | 947 | 72 | BD Biosciences (25), Dako (15), Beckman Coulter (8) |
| Integrin family members |
现在人们普遍认识到,驻留在绒毛和隐窝间的多能肠干细胞能推动上皮细胞的的不断补充。肠干细胞或隐窝细胞,具有自我更新和肠道组织再生的能力,其通过分化所成各种肠道细胞,包括内分泌细胞,肠细胞,杯状细胞和潘氏细胞。Wang等人表明Lrig1参与维持肠上皮稳态和标记肠中的干细胞 [79] 。最近的研究确定,LGR5作为一种新型的肠上皮和毛囊干细胞标记物 [80] 。研究表明,一小部分的慢循环表皮SCs被定位于表皮的基底层。有一个有趣的研究是关于毛囊隆突区域内的标记滞留细胞。这些细胞被认为是静息的,并且在应力和损伤时可被诱导增殖 [76] 。同样,Bmi1, Tert, Hopx 和 Lrig1也在LGR5(+)的肠干细胞中稳定表达 [81] 。此外,肠干细胞表达BMI-1和TERT [81, 82] ,肠网状干细胞能产生肠间质鞘并表达gremlin 1 [62].
| 蛋白质 | Uniprot登记号 | 基因ID | Num | 排名前三供应商 |
|---|---|---|---|---|
| Gremlin 1 | O60565 | 26585 | 2 | Novus Biologicals (1), Abgent (1) |
| Lrig1 | Q96JA1 | 26018 | ||
| Lgr5 | O75473 | 8549 | ||
| Bmi1 | P35226 | 648 | 3 | EMD Millipore (3) |
| Tert | O14746 | 7015 | 5 | Epitomics (1), EMD Millipore (1), Leica Biosystems (1) |
| Hopx | Q9BPY8 | 84525 |
Lgr5是多种上皮细胞的干细胞标记物,最近显示可作为卵巢和输卵管上皮的干/祖细胞的标记物 [83] 。
- Thomson J, Itskovitz-Eldor J, Shapiro S, Waknitz M, Swiergiel J, Marshall V, et al. Embryonic stem cell lines derived from human blastocysts. Science. 1998;282:1145-7 pubmed
- Evans M, Kaufman M. Establishment in culture of pluripotential cells from mouse embryos. Nature. 1981;292:154-6 pubmed
- Ying Q, Nichols J, Chambers I, Smith A. BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3. Cell. 2003;115:281-92 pubmed
- Nichols J, Zevnik B, Anastassiadis K, Niwa H, Klewe-Nebenius D, Chambers I, et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell. 1998;95:379-91 pubmed
- Loh Y, Wu Q, Chew J, Vega V, Zhang W, Chen X, et al. The Oct4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells. Nat Genet. 2006;38:431-40 pubmed
- Zhou Q, Chipperfield H, Melton D, Wong W. A gene regulatory network in mouse embryonic stem cells. Proc Natl Acad Sci U S A. 2007;104:16438-43 pubmed
- Andrews P, Banting G, Damjanov I, Arnaud D, Avner P. Three monoclonal antibodies defining distinct differentiation antigens associated with different high molecular weight polypeptides on the surface of human embryonal carcinoma cells. Hybridoma. 1984;3:347-61 pubmed
- Andrews P, Matin M, Bahrami A, Damjanov I, Gokhale P, Draper J. Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin. Biochem Soc Trans. 2005;33:1526-30 pubmed
- Draper J, Pigott C, Thomson J, Andrews P. Surface antigens of human embryonic stem cells: changes upon differentiation in culture. J Anat. 2002;200:249-58 pubmed
- Schopperle W, DeWolf W. The TRA-1-60 and TRA-1-81 human pluripotent stem cell markers are expressed on podocalyxin in embryonal carcinoma. Stem Cells. 2007;25:723-30 pubmed
- Buhring H, Battula V, Treml S, Schewe B, Kanz L, Vogel W. Novel markers for the prospective isolation of human MSC. Ann N Y Acad Sci. 2007;1106:262-71 pubmed
- Shamblott M, Axelman J, Wang S, Bugg E, Littlefield J, Donovan P, et al. Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc Natl Acad Sci U S A. 1998;95:13726-31 pubmed
- Fox N, Shevinsky L, Knowles B, Solter D, Dawjanov I. Distribution of murine stage-specific embryonic antigens in the kidneys of three rodent species. Exp Cell Res. 1982;140:331-9 pubmed
- Okoye U, Malbon C, Wang H. Wnt and Frizzled RNA expression in human mesenchymal and embryonic (H7) stem cells. J Mol Signal. 2008;3:16 pubmed
- Levine A, Brivanlou A. GDF3, a BMP inhibitor, regulates cell fate in stem cells and early embryos. Development. 2006;133:209-16 pubmed
- Lonardo E, Parish C, Ponticelli S, Marasco D, Ribeiro D, Ruvo M, et al. A small synthetic cripto blocking Peptide improves neural induction, dopaminergic differentiation, and functional integration of mouse embryonic stem cells in a rat model of Parkinson's disease. Stem Cells. 2010;28:1326-37 pubmed publisher
- Nakagawa M, Koyanagi M, Tanabe K, Takahashi K, Ichisaka T, Aoi T, et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nat Biotechnol. 2008;26:101-6 pubmed
- Ghaleb A, Nandan M, Chanchevalap S, Dalton W, Hisamuddin I, Yang V. Krüppel-like factors 4 and 5: the yin and yang regulators of cellular proliferation. Cell Res. 2005;15:92-6 pubmed
- Hatano S, Tada M, Kimura H, Yamaguchi S, Kono T, Nakano T, et al. Pluripotential competence of cells associated with Nanog activity. Mech Dev. 2005;122:67-79 pubmed
- Ohinata Y, Payer B, O'Carroll D, Ancelin K, Ono Y, Sano M, et al. Blimp1 is a critical determinant of the germ cell lineage in mice. Nature. 2005;436:207-13 pubmed
- Saitou M, Barton S, Surani M. A molecular programme for the specification of germ cell fate in mice. Nature. 2002;418:293-300 pubmed
- Sato M, Kimura T, Kurokawa K, Fujita Y, Abe K, Masuhara M, et al. Identification of PGC7, a new gene expressed specifically in preimplantation embryos and germ cells. Mech Dev. 2002;113:91-4 pubmed
- Geijsen N, Horoschak M, Kim K, Gribnau J, Eggan K, Daley G. Derivation of embryonic germ cells and male gametes from embryonic stem cells. Nature. 2004;427:148-54 pubmed
- Ben-Haim N, Lu C, Guzman-Ayala M, Pescatore L, Mesnard D, Bischofberger M, et al. The nodal precursor acting via activin receptors induces mesoderm by maintaining a source of its convertases and BMP4. Dev Cell. 2006;11:313-23 pubmed
- Spangrude G, Heimfeld S, Weissman I. Purification and characterization of mouse hematopoietic stem cells. Science. 1988;241:58-62 pubmed
- Kondo M, Weissman I, Akashi K. Identification of clonogenic common lymphoid progenitors in mouse bone marrow. Cell. 1997;91:661-72 pubmed
- Akashi K, Traver D, Miyamoto T, Weissman I. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 2000;404:193-7 pubmed
- Al-Hajj M, Wicha M, Benito-Hernandez A, Morrison S, Clarke M. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-8 pubmed
- Phillips T, McBride W, Pajonk F. The response of CD24(-/low)/CD44+ breast cancer-initiating cells to radiation. J Natl Cancer Inst. 2006;98:1777-85 pubmed
- Li C, Heidt D, Dalerba P, Burant C, Zhang L, Adsay V, et al. Identification of pancreatic cancer stem cells. Cancer Res. 2007;67:1030-7 pubmed
- Prince M, Sivanandan R, Kaczorowski A, Wolf G, Kaplan M, Dalerba P, et al. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc Natl Acad Sci U S A. 2007;104:973-8 pubmed
- Dalerba P, Dylla S, Park I, Liu R, Wang X, Cho R, et al. Phenotypic characterization of human colorectal cancer stem cells. Proc Natl Acad Sci U S A. 2007;104:10158-63 pubmed
- Ricci-Vitiani L, Lombardi D, Pilozzi E, Biffoni M, Todaro M, Peschle C, et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445:111-5 pubmed
- Singh S, Clarke I, Hide T, Dirks P. Cancer stem cells in nervous system tumors. Oncogene. 2004;23:7267-73 pubmed
- Singh S, Hawkins C, Clarke I, Squire J, Bayani J, Hide T, et al. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401 pubmed
- O'Brien C, Pollett A, Gallinger S, Dick J. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106-10 pubmed
- Patrawala L, Calhoun T, Schneider-Broussard R, Li H, Bhatia B, Tang S, et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 2006;25:1696-708 pubmed
- Hermann P, Huber S, Herrler T, Aicher A, Ellwart J, Guba M, et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007;1:313-23 pubmed
- Fan X, Matsui W, Khaki L, Stearns D, Chun J, Li Y, et al. Notch pathway inhibition depletes stem-like cells and blocks engraftment in embryonal brain tumors. Cancer Res. 2006;66:7445-52 pubmed
- Fuchs E, Coulombe P. Of mice and men: genetic skin diseases of keratin. Cell. 1992;69:899-902 pubmed
- 63.
- Tanei T, Morimoto K, Shimazu K, Kim S, Tanji Y, Taguchi T, et al. Association of breast cancer stem cells identified by aldehyde dehydrogenase 1 expression with resistance to sequential Paclitaxel and epirubicin-based chemotherapy for breast cancers. Clin Cancer Res. 2009;15:4234-41 pubmed publisher
- Iida M, Heike T, Yoshimoto M, Baba S, Doi H, Nakahata T. Identification of cardiac stem cells with FLK1, CD31, and VE-cadherin expression during embryonic stem cell differentiation. FASEB J. 2005;19:371-8 pubmed
- Agata H, Asahina I, Yamazaki Y, Uchida M, Shinohara Y, Honda M, et al. Effective bone engineering with periosteum-derived cells. J Dent Res. 2007;86:79-83 pubmed
- Corti S, Nizzardo M, Nardini M, Donadoni C, Locatelli F, Papadimitriou D, et al. Isolation and characterization of murine neural stem/progenitor cells based on Prominin-1 expression. Exp Neurol. 2007;205:547-62 pubmed
- Capela A, Temple S. LeX/ssea-1 is expressed by adult mouse CNS stem cells, identifying them as nonependymal. Neuron. 2002;35:865-75 pubmed
- Rietze R, Valcanis H, Brooker G, Thomas T, Voss A, Bartlett P. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature. 2001;412:736-9 pubmed
- Conget P, Minguell J. Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells. J Cell Physiol. 1999;181:67-73 pubmed
- Cotsarelis G, Kaur P, Dhouailly D, Hengge U, Bickenbach J. Epithelial stem cells in the skin: definition, markers, localization and functions. Exp Dermatol. 1999;8:80-8 pubmed
- Pittenger M, Mackay A, Beck S, Jaiswal R, Douglas R, Mosca J, et al. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-7 pubmed
- 来邦网
- 英文来邦
- 基因
- ATP结合转运蛋白B超家族成员1
- ATP结合转运蛋白G超家族成员2
- ALDH1A1
- ALPP
- BAP1
- BCAP31
- BMI1
- 骨形态发生蛋白2
- C-kit
- CD10
- CD105
- CD11b
- CD13
- CD133
- CD15
- CD150
- CD24
- CD244
- CD34
- CD38
- CD4
- CD44
- CD45
- CD48
- CD56
- CD73
- CD90
- CHRD
- Cx43
- DAX 1
- DAZL
- DKK3
- DLL1
- DPPA3
- 表皮生长因子受体
- FABP3
- FBXO15
- FGF-2
- FGF8
- FGFR4
- FLT3
- FOXJ3
- FZD1
- FZD9
- GBX2
- GDF1
- GDF3
- GDF9
- GREM1
- HER2
- HOPX
- ICAM-1
- IFITM1
- IGF-IR
- IGFBP-3
- ISL1
- ITGA6
- ITGA7
- KLF2
- KLF4
- KLF5
- KRT10
- KRT15
- KRT5
- KRT8
- G蛋白偶联受体5
- LIN28A
- LRIG1
- M-CSF
- MCAM
- MYCN
- MYH9
- NAC1
- NANOG
- NANOS1
- NKX2 5
- NOG
- OTX2
- Oct4
- PDGFR乙
- 血小板-内皮细胞粘附分子1
- PIWIL2
- PODXL
- PRDM1
- Pax2
- Pax6
- RANKL
- RIF1
- RPSA
- runt相关转录因子2
- SALL4
- SCUBE3
- SOST
- SOX1
- SOX15
- SOX18
- SOX2
- SOX3
- SPARC
- TBX3
- TCF3
- TCL1
- TDGF1
- TEKT1
- 端粒末端转移酶逆转录酶
- TGF-乙一
- TGFBR2
- TNC
- TNNI3
- TSTD3
- TUBB
- VASA
- VE钙粘蛋白
- VEGFR-2
- ZBP 99
- 甲辅肌动蛋白
- alpha myosin heavy chain
- β1整合素
- c-Myc
- 胱氨酸-天冬氨酸蛋白酶3
- 细胞角蛋白14
- 细胞角蛋白18
- decorin
- 索蛋白
- 纤维连接蛋白
- 卵泡抑素
- nestin
- 骨钙素
- 骨桥蛋白
- osterix
- p63
- p75NTR
- rhodanese
- 甲状腺过氧化物酶
- Ⅰ型胶原
- Ⅱ型胶原
