A review of protein quantitation assays and a survey about the protein assays based on formal publications.
精确的蛋白质定量是蛋白质相关实验所必需的,这些实验涉及分子生物学,细胞生物学,生物化学,发育生物学和神经科学的研究课题。 蛋白质定量分析有多种不同方法,包括样品的总蛋白定量和单种蛋白成分的定量。 总蛋白定量的分析方法,包括传统方法,例如测量在280 nm的紫外吸光值,二喹啉酸(BCA)和Bradford检测法,以及其他替代方法,例如Lowry检测法或由公司开发的新型检测试剂盒。针对总蛋白定量分析的每种方法,商业公司都专门开发了方便易用的试剂盒。 单种蛋白质的定量方法,包括酶联免疫吸附试验(ELISA),免疫印迹分析,以及最近的质谱等。 在特殊情况下根据贸易商的规定需要特殊的蛋白定量方法。比如国际血清工业协会(血清供应商组织,www.serumindustry.org)建议采用Biuret法检测血清蛋白含量。
我们讨论蛋白质定量的一些常用方法,并且指出这些方法的用途和局限。值得注意的是,所有这些蛋白质检测方法都既不是蛋白质特异的(一些非蛋白质成分可能会干扰检测值),也不是对所有的蛋白质都同样准确和兼容。此外,某些情况下蛋白修饰会干扰测定结果 [1, 2] 。某些方法如CBQCA法高效测定表面吸附或者包覆蛋白 [3] 。
表一总结了常用的总蛋白定量分析方法。对于每种分析方法的兼容性,研究人员有必要评估检测样品的类型,检测范围和样本量,是否有合适的分光光度计,以及每个检测所需的时间和成本。
| 方法 | 吸收波长 | 机制 | 检测限 | 优点 | 缺点 |
|---|---|---|---|---|---|
| 紫外吸收光 | 280 nm | 酪氨酸和色氨酸吸收光 | 0.1-100 mg/ml | 样本量小,快速,成本低 | 不兼容去污剂和变性剂,变异高 |
| 二喹啉酸 | 562 nm | 铜还原(Cu2+ 到 Cu1+), BCA 与 Cu1+反应 | 20-2000 mg/ml | 兼容去污剂和变性剂,变异低 | 低或不兼容还原剂 |
| Bradford或考马斯亮蓝 | 470 nm | 考马斯亮蓝染料和蛋白质之间形成复合物 | 20-2000 mg/ml | 兼容还原剂,快速 | 不兼容去污剂 |
| Lowry | 750 nm | 蛋白质还原铜, 铜-蛋白质复合物还原Folin-Ciocalteu | 10-1000 mg/ml | 高灵敏度和准确 | 不兼容去污剂和还原剂, 过程长 |
因为芳香族氨基酸,酪氨酸和色氨酸,蛋白质在280nm有特征性紫外(UV)吸收光谱。 这通常被用来估计蛋白质浓度。苯丙氨酸和二硫键,在这个波长也有轻微的吸光度。这种方法很简单,而且因为新分光光度计在测量时采用了样品保留系统,所以需要的样品量很小。然而,蛋白质样品必须是纯的,不能包含具有相同吸收光谱的任何非蛋白质成分,例如核酸的污染 [4] 。这种方法是最快速的,但缺点是容易出错。
二喹啉酸(BCA)法是Paul K. Smith于1985年在Pierce Chemical公司发明的。 该公司是BCA检测法的主要分销商 [5] 。BCA检测法和Lowry检测法都是基于Cu2+在碱性条件下转换为Cu1+。这种转换被定义为双缩脲反应。该反应受四个氨基酸残基(半胱氨酸,胱氨酸,酪氨酸和色氨酸),以及多肽主链的影响。
BCA 是Cu1+的一种特定显色剂,在反应的第二步,两个BCA分子和一个Cu1+离子发生反应。Cu2+被还原的数量是蛋白质浓度的函数,样品溶液的颜色变化成紫色,可以通过分光光度计测量在562 nm处的吸光度。吸光度与溶液中蛋白质的量是直接成正比的。 通过与已知蛋白标准,例如牛血清白蛋白(BSA)相比较,可估算蛋白含量 [4, 6, 7] 。
在一定范围的离子和非离子型去污剂如NP-40和Triton X-100,变性剂如尿素和盐酸胍,不会干扰BCA分析法,但往往会干扰Lowry等其他蛋白比色测定法(表二) [7] 。某些化学分子,例如还原糖,会干扰BCA分析法。可以通过几种措施消除或减少这些干扰的影响,例如通过透析,凝胶过滤去除干扰物质,或者如果蛋白的浓度足够高,可以通过稀释样品。Reichelt等提出一种可见的简单方法提高检测准确性,特别适用于混合溶液如培养基里的未纯化蛋白 [8] 。他们用一种源于BCA检测方法里的相关因子,BCA蛋白定量的准确率提高了5倍,使BCA法与其它昂贵的方法媲美 [8] 。
蛋白中化学修饰残基是影响BCA法的另一大因素。Brady and Macnaughtan在研究賴氨酰甲基化影响时发现采用BCA法测定甲基化蛋白,蛋白含量均被高估 [2] 。
| NP-40 | 蔗糖 |
| Emulgen | 甘氨酸, pH 2.8 |
| HEPES | 葡萄糖 |
| DTT | EDTA |
| Triton X-100 | NaCl |
| 尿素 | NaOH |
| 盐酸胍 | 硫酸铵 |
| 醋酸钠, pH 5.5 | SDS |
Thermo Fisher Pierce 最近新推出了改进的Pierce BCA 蛋白检测法,可以兼容还原剂如二硫苏糖醇(DTT),2-巯基乙醇(BME),TCEP和其他二硫键还原剂 [9] 。 BCA检测法是最敏感的蛋白定量法之一(检测下限达到5 ug/mL),变异低于其他方法(Bradford法),而且可以测量的蛋白质浓度范围很宽。
Bradford方法最初是Dr. Marion Bradford 于1976年定义的。是测量蛋白质浓度的最常用方法之一。原理是考马斯亮蓝G-250染料和溶液中的蛋白质结合形成复合物。未结合的染料,有四种不同的离子形式。较蓝的阴离子形式和蛋白质结合,在590 nm处有吸光度。蛋白质浓度可以通过测定蓝色离子形式染料的量,通过分光光度计测量溶液在595 nm的吸光度 [10] 。染料主要是结合于蛋白质的精氨酸,色氨酸,酪氨酸,组氨酸,苯丙氨酸残基 [4] 。
大多数研究人员使用牛血清白蛋白(BSA)作为标准蛋白,主要是因为BSA价格低廉,容易获得,但它并不总是合适的。事实上,BSA作为标准蛋白的缺点之一就是它与染料的结合反应很强,可能导致低估样本蛋白质含量。根据样品蛋白质的类型,可以使用免疫球蛋白G(IgG)或溶菌酶等??其他标准蛋白 [10] 。
Bradford法的一个优点是可以兼容溶液中用于稳定蛋白质的还原剂,而Lowry法不能兼容还原剂,BCA法在一定程度上也不能兼容还原剂。 Bradford法的局限是不能兼容通常用来溶解膜蛋白的低浓度去污剂。然而,可以通过凝胶过滤,透析,或磷酸钙沉淀蛋白质,以除掉去污剂 [10] 。Bradford法的另一个优点是可以检测高分子量(MW)的蛋白质,因为染料不结合低分子量的多肽 [4, 10] 。
在一般情况下,Bradford法是一种快速,准确的测量蛋白质浓度的方法。因此,Bradford法是蛋白质定量检测的最常用方法之一。
Lowry法是Oliver H. Lowry 于1951年提出的,基于两个化学反应。第一个反应是在碱性条件下铜离子的还原,与肽键形成复合物(缩二脲反应)。第二个反应是铜-肽键复合物对Folin-Ciocalteu试剂的还原,致使溶液的颜色变成蓝色,通过分光光度计在650至750nm 的范围检测吸光值 [4] 。使用选定的标准蛋白溶液,例如BSA的标准曲线,估算样品的蛋白含量。
Lowry法的优点在于其灵敏度,最重要的是准确性高。但是,Lowry法比其他检测法所需的时间更长,而且蛋白制备缓冲液中常用的许多化合物(例如,去污剂,糖类,甘油,甘氨酸,EDTA,Tris)都干扰Lowry法并形成沉淀(表三) [4] 。尽管如此,只要蛋白浓度足够高,就可以通过稀释样品,从而减少这些化合物的作用 [11] 。此外,已经证实通过提高温度或使用微波炉,Lowry法所需的时间就能缩短 [11] 。
| 去污剂 | 二硫键化合物 |
| 糖类 | 酚 |
| 甘油 | Uric acid |
| Tricine | 鸟苷 |
| EDTA | 黄嘌呤 |
| Tris | 镁钙 |
| 钾化合物 | 巯基化合物 |
CBQCA(3-(4-羧基苯甲酰)喹啉-2-甲醛)是一种灵敏的检测蛋白胺显色剂。因为只能检测蛋白中可接触胺,这个方法跟分光光度法有相同的局限性:结果取决于蛋白特定氨基酸的数目。但是CBQCA非常灵敏,能够检测出100μl体积里100ng到1500μg蛋白。此外CBQCA试剂对一些其它检测方法的干扰物质不敏感 [12] ,比如脂质,也能用于检测表面吸附或内包覆的多肽和蛋白 [3] 。
许多实验的一个关键步骤是溶液中特定蛋白的定量分析。有几种方法可以使用。常用的方法是酶联免疫吸附试验(ELISA),免疫印迹分析(Western blot)和质谱(Mass Spectrometry)。ELISA和Western blot将在 抗体应用部分介绍;此处简单介绍质谱(MS),详情见Labome综述文章:基于质谱法的蛋白质定量生物分析(Quantitative Bioanalysis of Proteins by Mass Spectrometry)。
蛋白质质谱是蛋白质定量的新兴方法。在蛋白质组学分析中,除了蛋白定性之外,一个重要的步骤就是对特定的蛋白的定量。质谱蛋白定量的方法有很多。常用的方法,较重的稳定同位素例如碳13(13C)或氮15(15N)加入到第一个样本(多肽或蛋白质),而相应的轻同位素例如碳12(12C)和氮14(14N)加入到第二个样本(内标),然后混合这两个样本进行分析。由于两个样本的质量差,用质谱分析仪测定的两个样本峰强度的比值,就相当于其相对丰度比。质谱蛋白定量的第二种方法,可以不用标记样本(即用基质辅助激光解吸/电离 - MALDI分析) [13] 。
这里,我们要强调的是,使用质谱这种通用方法就可以在一次实验中同时定量和定性检测。例如有很多基于质谱的特定蛋白定量分析方法,包括一种定量分析血清中胰岛素样生长因子1的方法 [14] ,一种定量分析尿中白蛋白和血浆中泛醌的方法 [15, 16] 。还包括一些检测更低特异性靶蛋白的方法。在快速发展中,多肽和蛋白的质谱靶向检测指南能确保方法的准确性和可比性。然而,这种方法需要的检测仪器不是任何实验室都能买得起,可能限制了这种方法的使用 [5, 11] 。
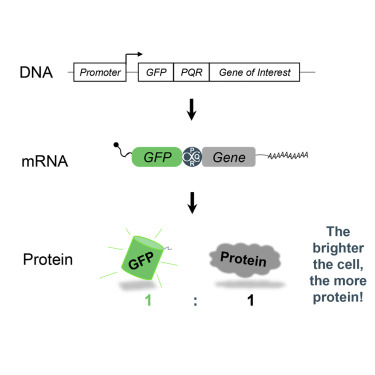
活细胞中蛋白表达可以通过基因手段引入特异蛋白监控,比如绿色荧光蛋白(Green fluorescent protein, GFP)。将蛋白跟具有特定順式作用水解酶连接称作蛋白定量报告分子(Protein quantitation reporter, PQR) [17] ,能让蛋白和报告分子一起转录但是翻译为不同功能的蛋白,这能确保蛋白和报告分子以化学计量比进行表达。因此,蛋白含量可以通过荧光强度推算(图4)。
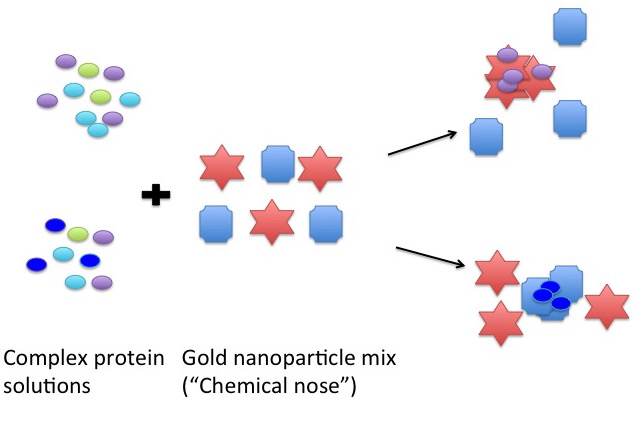
前述方法的局限性激发了蛋白质定量分析的新发展。基于纳米颗粒光学性质的方法就是其中之一 [18] 。简言之,分子偶联或颗粒聚集会导致纳米颗粒吸收波长的移动 [19] 。因为吸收光谱在可见光区域,所以颜色变化反映了吸收波长的移动。纳米颗粒通过化学交联跟蛋白质连接,例如抗体、多肽和配体。Rogowski提出了一种用于蛋白质检测和定量的新型纳米传感器,称为“化学鼻子” [20] 。传感器由不同形貌的金纳米颗粒混合而成,跟不同的蛋白质相互作用而生成不同的聚集体(图5)。基于吸收光谱,纳米颗粒可以实现溶液中蛋白质的检测和定量。
Kong等发展了一种基于长链DNA载体分子和固态玻璃纳米孔实现溶液中纳摩尔级别蛋白质的检测 [21] 。其中DNA载体分子可以结合特定位置的蛋白质,在电流的作用下通过纳米孔。DNA在变位时会产生一个下降的电流信号。如果这个DNA吸附了蛋白质则会产生一个额外的下降信号。蛋白浓度越高,吸附在纳米颗粒表面的量就越大,二级电流的降低就会越大(图6)。
Labome随机选取了大量有关总蛋白质检测的同行评审文献。Thermo Fisher Pierce公司 和 Bio-Rad 实验室是总蛋白检测试剂的主要供应商(表四)。BCA法和Bradford是最常用的方法。
| 测试法 | 供应商 | 数量 | 代表性文章 | ||
|---|---|---|---|---|---|
| BCA | 142 | ||||
| Thermo Fisher Pierce | 114 | #23225 [22] | |||
| Sigma | 8 | ||||
| Beyotime | 2 | ||||
| others | 2 | ||||
| not specified | 10 | ||||
| Bradford | 78 | ||||
| Bio-Rad | 52 | ||||
| Thermo Fisher Pierce | 9 | ||||
| Sigma | 1 | ||||
| not specified | 10 | ||||
| Lowry / modified DC Assay | 21 | ||||
| Bio-Rad | 17 | ||||
| Sigma | 1 | ||||
| not specified | 2 | ||||
| UV detection at 280 nm | 12 | ||||
| Thermo Scientific (Nanodrop) | 3 | ||||
| not specified | 8 | ||||
几乎所有的BCA蛋白检测试剂都是Thermo Fisher Pierce提供的,BCA 检测法就是该公司的一名科学家在许多年前发明。Thermo Fisher在数年前收购了Pierce。Thermo Fisher Pierce BCA 检测法,用于研究甲状腺癌 [23] ,在细胞分裂中VLDLR的作用 [24] ,S100A4蛋白翻译后修饰 [25] ,hnRNP H 蛋白和 hnRNP F蛋白作为FGFR2(成纤维细胞生长因子受体2)的沉默子 [26] ,子宫内膜异位症中StAR和芳香酶活性增加的机制 [27] ,细胞粘附和铺展中肝素酶(heparanase)的作用 [28] ,经过VES-处理的PC-3人类前列腺癌细胞中NAG-1表达的调控和作用 [29] ,在感光细胞功能中IGF-1R的作用 [30] ,在成骨细胞-破骨细胞的耦合中 Dlx5的作用 [31] ,以及许多其他研究 [32], [33] 。微量BCA蛋白检测试剂盒被用来研究osteopontin在鸟蛋壳腺和蛋壳的免疫细胞化学定位 [34] ,研究大鼠控制皮层撞伤(CCI)后的恢复 [35] ,丙肝病毒核心蛋白的膜定位和病毒扩增 [36] 。
Sigma BCA 试剂 [37] 和Bio-Rad BCA蛋白检测试剂盒也被文献引用。
Thermo Fisher Pierce 也是Bradford 检测试剂盒的主要供应商之一。Pierce Biotechnology Coomassie / Bradford 检测试剂盒被用于研究伴侣蛋白ERp29的表达 [38] ,YKL-40在调节碱性成纤维细胞生长因子的生物活性中的作用 [39] ,以及其他的研究课题 [40, 41] 。
Bio-Rad Bradford 蛋白检测试剂盒被许多文献引用 [42-44] 。 其他供应商也提供了Bradford检测试剂盒,例如, Expedeon [45] 和 Sigma [46, 47] 。
Pierce Lowry assay (产品号 23240) 被文献引用 [47] 和Bio-Rad Laboratories Lowry assay被文献引用 [48, 49] 来定量蛋白浓度。Bio-Rad DC蛋白检测是一个Lowry检测方法的修订版,因与去污剂兼容而大受欢迎。它被用在一些需要蛋白定量的研究中,包括研究人类四跨膜蛋白CD81 [50] 的结构和功能,mdx表型伽马肌动蛋白的骨骼肌特异切除的影响 [47] 和一些其它研究 [51, 52] 。
最好的标准就是目标蛋白质本身。但是通常并不可行。牛血清白蛋白(Bovine serum albumin,BSA)是最常用的标准物。但有局限性,它在Bradford方法中比其它蛋白质更敏感,蛋白质浓度很可能被低估。此外,BSA作为血清蛋白与很多因子结合,因而无法获得高纯度。其它蛋白如免疫球蛋白(Immunoglobulin G, IgG)和溶菌酶也被用作蛋白标准物。对于给定的实验,根据所研究蛋白和采用的定量方法不同,最优化的蛋白标准物也有所不同。
不能!标准曲线在更低或更高浓度的变化无法确定,因此务必保证样品数据值在标准曲线范围内。通过调整样品或标准物的浓度就可以使数据值在标准曲线范围内。
- Noble J, Knight A, Reason A, Di Matola A, Bailey M. A comparison of protein quantitation assays for biopharmaceutical applications. Mol Biotechnol. 2007;37:99-111 pubmed
- Smith P, Krohn R, Hermanson G, Mallia A, Gartner F, Provenzano M, et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 1985;150:76-85 pubmed
- Walker J. The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol. 1994;32:5-8 pubmed
- Kruger N. The Bradford method for protein quantitation. Methods Mol Biol. 1994;32:9-15 pubmed
- Friedenauer S, Berlet H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Anal Biochem. 1989;178:263-8 pubmed
- You W, Ryan D, Haugland R. 3-(4-Carboxybenzoyl)quinoline-2-carboxaldehyde, a reagent with broad dynamic range for the assay of proteins and lipoproteins in solution. Anal Biochem. 1997;244:277-82 pubmed
- Jain P, Lee K, El Sayed I, El Sayed M. Calculated absorption and scattering properties of gold nanoparticles of different size, shape, and composition: applications in biological imaging and biomedicine. J Phys Chem B. 2006;110:7238-48 pubmed
- Oganesian A, Armstrong L, Migliorini M, Strickland D, Bornstein P. Thrombospondins use the VLDL receptor and a nonapoptotic pathway to inhibit cell division in microvascular endothelial cells. Mol Biol Cell. 2008;19:563-71 pubmed
- Zhou H, Yang H, Li Y, Wang Y, Yan L, Guo X, et al. Changes in Glial cell line-derived neurotrophic factor expression in the rostral and caudal stumps of the transected adult rat spinal cord. Neurochem Res. 2008;33:927-37 pubmed
- Ralhan R, DeSouza L, Matta A, Tripathi S, Ghanny S, Datta Gupta S, et al. Discovery and verification of head-and-neck cancer biomarkers by differential protein expression analysis using iTRAQ labeling, multidimensional liquid chromatography, and tandem mass spectrometry. Mol Cell Proteomics. 2008;7:1162-73 pubmed 出版商
- Leemput J, Masson C, Bigot K, Errachid A, Dansault A, Provost A, et al. ATM localization and gene expression in the adult mouse eye. Mol Vis. 2009;15:393-416 pubmed