干细胞因其能够自我更新(通过无限次分裂进行增殖)并分化成一系列特定谱系后代的能力与其他细胞区分开来。因此,干细胞提供了(研究)癌症、再生医学和衰老相关疾病的潜力。
根据他们的来源,干细胞可以被分为以下三类:1)胚胎干细胞(ES)来源于胚胎囊胚期(图1)的内细胞团,具有无限的自我更新和多潜能分化的能力 [1] 。它们能够以未分化的纯细胞系形式长时间培养增殖,并在多次传代后保持正常的核型 [2] 。人胚胎干细胞自1998年成功获得后,使胚胎干细胞在细胞治疗方面受到了广泛的关注,将这一概念向现实又推进了一步 [3] 。来源于人类和其它物种的单倍体胚胎干细胞已成功获得,它们被认为是基因缺失筛选的有用工具 [4] 。 2)成体干细胞可来源于多种成体组织,例如骨髓,血管,皮肤,肌肉和骨。它们具有若干分化潜能,体现在来源的组织。例如,造血干细胞(HSC)和间充质干细胞(MSC)存在于骨髓中 [5] ,而神经干细胞(NSCs)定位大在脑室下区和海马区 [6] 。癌症干细胞代表了保持干细胞样特性的一个小亚细胞群,具有在移植实验模型中诱导肿瘤形成的能力。 3)诱导多能性干细胞是通过异位表达转录因子的组合将分化的体细胞(即成纤维细胞)遗传重编程为去分化的干细胞 [7], [8] 。表1总结了不同类型的ES细胞。
| 多能干细胞 | 具有分化成全部三胚层(内胚层、中胚层、外胚层)的潜能的细胞 |
| 专能干细胞 | 具有分化成某一特定谱系中多种细胞类型的潜能的细胞(即造血干细胞 |
| 全能干细胞 | 具有能够发育成一个完整的生物体以及分化成任何种类细胞或组织的潜能的细胞(如受精卵,早期卵裂球) |
| 胚胎干细胞 | 来源于囊胚内细胞团的多能性干细胞 |
| 诱导多能性干细胞 | 将分化的细胞通过异位表达转录因子的组合( 即 Oct4, Sox2, Klf4,c-Myc)获得的多能性干细胞 |
| 成体干细胞 | 来自某一组织中分化细胞群里的未分化细胞,具有有限的自我更新能力和专能分化潜能 |
| 癌症干细胞 | 在肿瘤组织中具有自我更新和分化能力的小亚细胞群 |
来源于人、小鼠和其他物种的胚胎干细胞(ES细胞)集中体现了遗传学,发育生物学和生物医学研究的重大突破之一。在体外培养条件下维持ES未分化和多能性状态需要生长成分的组合。下面我们将介绍有助于维持干细胞的自我更新的几个因素。
ES细胞生长在含饲养层,血清和外源因子的培养基中。血清中主要的粘附因子是纤连蛋白和玻连蛋白。饲养细胞释放纤连蛋白、I型和IV型胶原蛋白以及层粘连蛋白。对于小鼠ES细胞,饲养层可以简单地通过加入骨形态发生蛋白(BMP)和白血病抑制因子(LIF)来取代。人ES细胞最初是培养在小鼠胚胎成纤维细胞(MEF)饲养层上 [3] ,胎牛血清(FCS)培养基中。现在,人类ES细胞培养在无血清替代品(KSR)和碱性成纤维细胞生长因子(FGF2),铺有MEF饲养层细胞或施加饲养细胞调理过的培养基中 [9] 。此组合因包含外源物质,成为临床应用一个显著缺点。
白血病抑制因子(LIF)被用来维持小鼠ES细胞的自我更新。 LIF引起LIF受体和糖蛋白130 (gp130)异二聚体的形成,并进一步激活酪氨酸激酶Jak。被激活的Jak磷酸化若干种蛋白,包括信号转导因子和转录因子的转录(Stat)家族激活蛋白。 LIF通过转录因子Stat3的活化维持小鼠ES细胞的自我更新 [10] 。与此相反,人类ES细胞的多能性维持不依赖于LIF/ Stat3,但需要Activin/Nodal 以及FGF信号传导通路 [11] 。这种区别与这两种细胞类型来源的发育时期有关。
干细胞的微环境,也称为干细胞的小生境(niche),在干细胞的自我更新和分化过程中起关键作用。该小生境是由粘附在支持细胞上的干细胞和固定在细胞外基质(ECM)中的可溶性因子组成 [12] 。.外基质是由一系列纤维状结构蛋白(即胶原,纤连蛋白,层粘连蛋白,弹性蛋白和玻连蛋白)和多糖(即糖胺聚糖)构成,并对细胞信号分子提供机械支撑和储存。细胞通过被称为整合素(integrins)的受体与ECM成分互作,并通过被称为钙粘素(cadherins)的受体与邻近细胞相互作用。细胞因子如wingless-相关(Wnts)和hedgehog蛋白、成纤维细胞生长因子(FGFs)和骨形态发生蛋白(BMPs)是有助于干细胞功能的可溶性因子 [13], [14] 。
生物材料已经应用到体外培养ES细胞。例如,小鼠ES细胞生长在基于聚酰胺的3D纳米纤维状多孔基质上 (Ultra-Web)™,并添加LIF的培养基中 [15] 。人类ES细胞也可以培养在无饲养层细胞的培养基中。它们可以在涂有活性组分(即层粘连蛋白,胶原和基底胶Matrigel™)培养皿中,同时补充了替换血清和生长因子(即FGF)的MEF调理过的培养基中进行培养 [16] 。基质胶(Matrigel)是由天然基底膜的提取物(含有层粘连蛋白,IV型胶原,巢蛋白,硫酸乙酰肝素蛋白多糖以及其他组分)构成的商业化产品 [17] 。
ES细胞拥有内在的能力维持多能性而不需要外源性刺激。在化学成分确定的条件下有些小分子维持胚胎干细胞的自我更新。例如 Pluripotin(SC1),一种小分子,通过阻断内源性分化诱导蛋白(包括RasGTP酶激活蛋白(RasGAP)和胞外信号调节激酶-1(ERK1) [18] )的表达保持小鼠ES细胞体外培养的自我更新和生成生殖细胞的能力。另外,联合利用糖原合酶激酶-3(GSK3)和丝裂原活化蛋白激酶/ ERK激酶(MEK)的特异化学抑制剂同样可以在不存在外源性细胞因子的条件下维持小鼠胚胎干细胞的自我更新和生殖系形成的能力 [19] 。Noggin,一种BMP拮抗剂,与bFGF协同作用抑制BMP信号通路,维持人类胚胎干细胞的未分化增殖 [20] 。
调节转录表达网络对维持ES细胞的自我更新和多能性,实现这些细胞的治疗潜能是至关重要的 [21] 。在体外将成纤维细胞诱导成多能性干细胞的重编程过程可以通过异位表达两套不同转录因子的组合来实现:1)Oct4,Sox2,c-myc和Klf4的组合 [22] 和2)Oct4,Sox2,Nanog和lin-28 [8] 。对干细胞多能性和自我更新重要的转录因子介绍如下:
Oct4(八聚体结合转录因子4,也被称为Oct3)是哺乳动物POU转录因子。 Oct4在卵裂球,ES细胞和原始生殖细胞中表达。它协调多个目的基因(包括成纤维细胞生长因子4(FGF4)编码基因)的表达。重要的是,FGF4缺失的小鼠胚胎能形成囊胚,但不能进一步着床。在胚胎和胚胎干细胞中沉默Oct4会导致多能性削弱和自发分化成滋养层细胞系 [23] 。
Nanog是在胚胎干细胞的自我更新和多能性中常提到的一个关键因素,它存在于桑椹胚和胚泡的内细胞团。它可以不依赖LIF/ STAT3来维持胚胎干细胞的自我更新。Nanog缺陷的细胞不能保持多能性而分化成胚外内胚层细胞系 [10] 。
SOX2是在ES细胞的自我更新的一个重要因子。此外,Sox2存在于胚外外胚层,滋养层干细胞和神经干细胞。 SOX2、Oct4与Nanog在人类和小鼠胚胎干细胞中协同作用 [24] 。在人ES细胞中,SOX2具有1279个结合位点,Oct4具有623个结合位点。他们有404个位点重叠,这些位点的87%(353个位点)又与Nanog的靶位点(1687个结合位点)重合 [25] 。
KLF4(Kruppel-样因子4)存在于多种组织,人为诱导KLF4表达能够抑制ES细胞在红细胞前体细胞中分化 [26] 。其在重编程过程中的确切作用还没有完全阐明,它可以被Klf家族的其他成员(KLF2和KLF5)或者其他转录因子如Nanog和Lin-28来代替 [27] 。
lin-28 ,在哺乳动物中也被称为锌指CCHC结构域蛋白1,是一个保守的RNA结合蛋白 [28] 。lin-28在小鼠和人胚胎干细胞表达量很高 [29] ,常被用来提高诱导人成纤维细胞转化成多能干细胞的效率 [27] 。
c-Myc是参与干细胞的自我更新和分化,特别是干细胞与局部微环境之间相互作用过程的转录因子 [30] 。 c-Myc也参与其他几个细胞功能,包括细胞周期调节,增殖,生长,分化和代谢。
干细胞群体可以利用荧光团释放、细胞表面标记物等方法手段分离出来。
荧光团释放(单独用若丹明123或与Hoechst 33342一起)可以用来区分不同骨髓细胞群; 具有更强干细胞活性的细胞组分与骨髓其他细胞组分相比表现出较低水平的荧光着色 [31] 。
细胞表面标记物:荧光激活细胞分选术(FACS)可以用于分析和分选出带有荧光标记的细胞。在这种技术中,将信号传导分子或特异亲和或结合细胞谱系特异标志物的抗体与荧光发光集团偶联。可应用的各种荧光探针产生不同的颜色和强度 [32] 。例如,一些针对造血谱系抗原的抗体已经用于检测造血干细胞(HSC)的富集,例如:1)T细胞相关抗原(THY-1),2)谱系抗体鸡尾酒(Lin-),3)干细胞抗原1(的Sca-1),4)酪氨酸激酶受体c-kit [33], [34] 。此外,在人类众多癌症已经可以用各种不同标记物来鉴定出癌症干细胞(CSC)。表2总结了白血病 [35] ,乳腺癌 [36] ,脑瘤 [37] ,骨髓瘤 [38] ,前列腺癌 [39] 和肺癌 [40] 的癌症干细胞(CSC)的细胞表面标记物。
| Cancer | 癌症干细胞标志物 | 文献 |
|---|---|---|
| 白血病 | CD34+/ CD38- | Bonnet et al. (1997) |
| 乳腺癌 | CD44+/ CD24-/low/Lineage- | Al-Hajj et al. (2003) |
| 脑瘤 | CD133+ | Singh et al. (2004) |
| 骨髓瘤 | CD138- | Matsui et al. (2004) |
| 前列腺癌 | CD44+/α2β1hi/CD133+ | Collins et al. (2005) |
| 肺癌 | Sca-1+/CD45-/Pecam- | Kim et al. (2005) |
干细胞可以通过使用1)细胞表面标记物分析,2)基因表达分析,3)分化潜能的生物测定,和4)基因组完整性检查来表征。流式细胞仪 [36], [38] 实现了定量分析培养物中表达特定表面标记物和多能性转录因子的细胞的比例,同时免疫染色 [40] 可以确定标记物的细胞定位。在早期代次以及之后规则时间间隔内多潜能标志物的基因表达水平可通过实时定量聚合酶链式反应(QRT-PCR)和DNA微阵列分析来检测。利用定量RT-PCR法可以检测单个基因的表达,而DNA微阵列分析可以用于同时测量许多基因的表达 [41] 。
报告基因可用于评估干细胞的分化。例如,可以向干细胞内转入表达荧光蛋白(如增强型绿色荧光蛋白)的报道基因 [42] 。该基因仅在细胞处于未分化的状态时表达(或报告)而当细胞分化后完全失活。一旦该报告基因被激活表达,未分化的干细胞就会发射荧光,因此可以利用FACS进行分析。用FACS分析的一个潜在缺点是,干细胞可能与内源性宿主细胞混杂,看起来像那些分化了的细胞 [36] 。
ES细胞可利用不同的方法被诱导分化成不同的细胞谱系,这些方法包括: 1) ES细胞聚集并形成三维集落称为胚体(EB ) [43] ,2) ES细胞与基质细胞(OP9基质细胞系)接触而分化 [44] ,3) ES单层细胞在胞外基质蛋白(例如钙粘蛋白)上发生分化 [45] 。
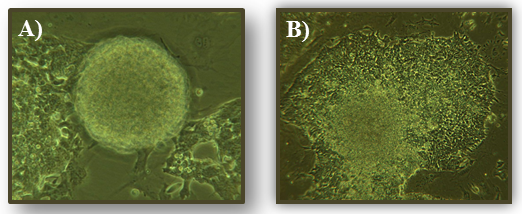
ES细胞分化起始于胚状体(EBs)的形成 [46] 。图2展示了在不含LIF(A),含有LIF以及饲养层细胞(B)的培养条件下小鼠ES细胞形成胚体(EB)的显微图片。胚体(EBs)可进一步用如下手段促进分化:1)施加生长因子,2)用明胶组织培养皿培养,3)悬浮培养。表3列出了用于诱导胚体成型的几种方法,如分离的悬浮培养,甲基纤维素培养,悬滴(HD)培养,转瓶培养,生物反应器培养和圆形微孔板 [47] 。EB提供了三维结构的优势,这样可以加强细胞之间的相互联系,在特定的发育阶段有着重要意义。胚体又存在一个缺点,因为这种结构中产生的细胞因子和诱导因子会使对特定谱系命运决定的信号通路的解释变得复杂。
| 甲基纤维素培养 | 由ES单细胞形成的胚体,通常用于造血分化 |
| 由ES单细胞形成的胚体,通常用于造血分化 | 具有高均一性和大小可控的胚体,用来将ES细胞向多种细胞类型分化 |
| 用细菌级培养皿悬浮培养 | 大小和形状不均一的胚体,用来将ES细胞向若干种细胞类型分化 |
| 转瓶培养或生物反应器 | 大规模形成胚体;胚体间存在过多细胞聚集 |
| 圆底96孔板(低粘附性孔) | 大小可控的胚体(类似悬滴培养);允许置换培养基和补充生长因子 |
ES细胞具有在适当的条件下自发地分化成代表所有三胚层细胞的潜力 [1] (图1)。例如,肝脏和胰腺器官源自内胚层,成为细胞治疗的主要焦点。中胚层细胞亚群产生造血,血管,心脏和骨骼肌谱系。外胚层诱导产生神经谱系和皮肤。在培养的小鼠ES中激活Activin(激活素)/ Nodal信号通路促进向内胚层诱导 [11] 。在ES细胞中,外胚层形成也被认为是“默认”途径,因为神经外胚层在无血清培养基中可以很容易地起始发生。诸如BMP,Wnt和Activin/Nodel信号通路的激活会阻止神经外胚层的产生 [48] (图4)。治疗性谱系重编程(转分化)的应用前景已经在再生医学的多个领域被探索。来自所有三种胚层的细胞类型已使用不同的转录因子组合被成功重新编程为诱导多能性干细胞。这里,我们介绍几类具有显著临床价值的靶细胞:如胰腺细胞,心脏细胞和神经元。

多种细胞类型已展现出体外或体内转分化成胰腺β细胞的潜力。胰腺十二指肠同源异性框因子-1(PDX-1)(一类包含同源结构域的转录因子)参与胰腺发育和胰岛素基因的转录。转导PDX-1蛋白可促使导管祖细胞分化成胰岛素生成细胞 [49] 。另外,通过激活胰高血糖素样多肽-1(GLP-1)受体介导的下游信号可以促进Pdx1介导的效应 [50] 。使用艾塞那肽-4(一种GLP-1受体的配体),在与体外过表达的Pdx1相结合,诱导肝细胞定向转分化成产生胰岛素的β细胞 [51] 。体内胰腺外分泌细胞已被证明可以用腺病毒转染表达三种转录因子诱导转分化成到胰腺内分泌β细胞,这三种转录因子为:Pdx1,Ngn3(neurogenin3),和MafA(v-maf肌肉腱膜纤维肉瘤癌基因家族,蛋白A) [52] 。这种直接通过谱系转分化获得产生胰岛素的β细胞的方法为治疗1型糖尿病铺平了一条有潜力的新途径。图5展示了体外细胞重编程例子的谱系—指导性方法列表。
ES细胞分化成心脏谱系的发育过程经过的特定阶段类似于在体内谱系进程。分化培养中,心脏基因以设置好的范式被诱导表达。转录因子GATA-4(结合DNA的 “GATA”序列)和Nkx2.5(与GATA4相互作用的同源异性框蛋白)的表达对谱系发育是必须的,他们的表达进一步激活了体内发育阶段特症性基因:ANP(心房钠尿蛋白),MLC(肌球蛋白轻链-2V),α-MHC(α肌球蛋白重链),β-MHC(β-肌球蛋白重链),以及连接蛋白43 [53], [54] 。有研究指出谱系重编程可以用来实现心肌细胞的再生。小鼠成纤维细胞可通过转导以下三个心源转录因子的组合转分化成心肌细胞:GATA4,Tbx5(T-box转录因子)和MEF2C(肌细胞特异增强子2C,也称为MADS框转录增强因子2) [55] 。成纤维细胞转分化成心肌细胞对解读心脏发育具有重要提示,并可能提供人体心血管疾病的潜在治疗方案。
研究表明,谱系重编程干预还可以应用于神经元再生。实现这一目标可以采取的方法如下:(1)用含视黄酸的培养基培养血清刺激的胚体 [56] ,(2)依次将胚体先养在含血清的培养基中,接着进行无血清培养 [57] ,(3)在无血清培养基中单层培养的胚胎干细胞(ES)会被诱导分化,通过抑制转化生长因子β(TGFβ)相关信号传导通路促进 ES的分化 [58] ,以及(4)在无血清和视黄酸的培养基中,将ES细胞与基质细胞共培养,ES受基质细胞的影响而分化 [59] 。
数项研究已提供证据表明通过转录因子介导的命运指令可以从人的体细胞中获得神经元的特定亚型。小鼠成纤维细胞可以在体外通过慢病毒转染表达神经系统转录因子的组合:ASCL1(achaete-scute同源蛋白1),Brn2(含POU结构域转录因子)和Myt1l(类髓鞘转录因子1)来重编程为有功能的神经元 [60] 。有研究报道:成体胶质细胞可以在体外通过诱导下列转录因子表达重编程为神经元:Pax6,Ngn2(神经元素-2),MASH1(哺乳动物achaete schute同源蛋白1) [61] 。通过这种途径可以将胶质细胞重编程获得神经元的特性:如内在兴奋性和动作电位。因此,在胶质细胞中通过Pax6启动的转录网络体现了再生性转分化的治疗前景。体外通过谱系-指导性方式重编程的例子见图5。
诱导多巴胺能神经元(此细胞类型在帕金森病中丢失),可以从小鼠、人的成纤维细胞通过以下两种方法实现:1)将一组转录因子(ASCL1,Brn2和Myt1l)与神经转换因子Lmx1a(LIM同源框转录因子1,α)和FOXA2(叉头框蛋白A2:forkhead box A2))相结合 [62] ;2)三种转录因子:MASH1、Nurr1(核受体相关蛋白1)和 Lmx1a(LIM同源框转录因子1,α)的组合 [63] 。这些神经元表现出与中脑多巴胺能神经元一致的表达模式和电生理特性:包括自动释放多巴胺。直接由体细胞诱导产生多巴胺能神经元可能对我们理解神经元发育的关键过程以及细胞替代疗法具有重要意义。
在过去的十年里,干细胞领域已取得了里程碑式的发展。 胚胎干细胞所具有的产生基本上任何分化类型细胞的能力推进了哺乳动物发育新模型的建立,并可能创造出新的细胞替代疗法。为了充分发掘胚胎干细胞的潜力,控制胚胎干细胞谱系分化和引导这些细胞按特定的分子途径发育是绝对必须的。与使用ES细胞相关的伦理问题可以由当前研究的成体干细胞的可塑性来调和,成体干细胞有可能成为再生医学的一种细胞来源以及能够控制免疫排斥问题。细胞重编程:即分化的细胞被引导改变自身命运,同时也是生物技术和医学重要方面的一个创新领域。随着新的研究进展被揭示,干细胞领域正在迅速发展,成为生物医学研究的最激奋人心的领域之一。
- Evans M, Kaufman M. Establishment in culture of pluripotential cells from mouse embryos. Nature. 1981;292:154-6 pubmed
- Keller G. Embryonic stem cell differentiation: emergence of a new era in biology and medicine. Genes Dev. 2005;19:1129-55 pubmed
- Thomson J, Itskovitz-Eldor J, Shapiro S, Waknitz M, Swiergiel J, Marshall V, et al. Embryonic stem cell lines derived from human blastocysts. Science. 1998;282:1145-7 pubmed
- 17.
- Conrad C, Huss R. Adult stem cell lines in regenerative medicine and reconstructive surgery. J Surg Res. 2005;124:201-8 pubmed
- Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126:663-76 pubmed
- Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007;131:861-72 pubmed
- Amit M, Carpenter M, Inokuma M, Chiu C, Harris C, Waknitz M, et al. Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Dev Biol. 2000;227:271-8 pubmed
- Mitsui K, Tokuzawa Y, Itoh H, Segawa K, Murakami M, Takahashi K, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell. 2003;113:631-42 pubmed
- Kubo A, Shinozaki K, Shannon J, Kouskoff V, Kennedy M, Woo S, et al. Development of definitive endoderm from embryonic stem cells in culture. Development. 2004;131:1651-62 pubmed
- de Haan G, Weersing E, Dontje B, van Os R, Bystrykh L, Vellenga E, et al. In vitro generation of long-term repopulating hematopoietic stem cells by fibroblast growth factor-1. Dev Cell. 2003;4:241-51 pubmed
- Zhang J, Niu C, Ye L, Huang H, He X, Tong W, et al. Identification of the haematopoietic stem cell niche and control of the niche size. Nature. 2003;425:836-41 pubmed
- Nur-E-Kamal A, Ahmed I, Kamal J, Schindler M, Meiners S. Three-dimensional nanofibrillar surfaces promote self-renewal in mouse embryonic stem cells. Stem Cells. 2006;24:426-33 pubmed
- Xu C, Inokuma M, Denham J, Golds K, Kundu P, Gold J, et al. Feeder-free growth of undifferentiated human embryonic stem cells. Nat Biotechnol. 2001;19:971-4 pubmed
- Chen S, Do J, Zhang Q, Yao S, Yan F, Peters E, et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 2006;103:17266-71 pubmed
- Xu R, Peck R, Li D, Feng X, Ludwig T, Thomson J. Basic FGF and suppression of BMP signaling sustain undifferentiated proliferation of human ES cells. Nat Methods. 2005;2:185-90 pubmed
- Wernig M, Meissner A, Foreman R, Brambrink T, Ku M, Hochedlinger K, et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 2007;448:318-24 pubmed
- 20.
- Nichols J, Zevnik B, Anastassiadis K, Niwa H, Klewe-Nebenius D, Chambers I, et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell. 1998;95:379-91 pubmed
- Yuan H, Corbi N, Basilico C, Dailey L. Developmental-specific activity of the FGF-4 enhancer requires the synergistic action of Sox2 and Oct-3. Genes Dev. 1995;9:2635-45 pubmed
- Boyer L, Lee T, Cole M, Johnstone S, Levine S, Zucker J, et al. Core transcriptional regulatory circuitry in human embryonic stem cells. Cell. 2005;122:947-56 pubmed
- Li Y, McClintick J, Zhong L, Edenberg H, Yoder M, Chan R. Murine embryonic stem cell differentiation is promoted by SOCS-3 and inhibited by the zinc finger transcription factor Klf4. Blood. 2005;105:635-7 pubmed
- Yu J, Vodyanik M, Smuga-Otto K, Antosiewicz-Bourget J, Frane J, Tian S, et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 2007;318:1917-20 pubmed
- Richards M, Tan S, Tan J, Chan W, Bongso A. The transcriptome profile of human embryonic stem cells as defined by SAGE. Stem Cells. 2004;22:51-64 pubmed
- 39.
- Murphy M, Wilson A, Trumpp A. More than just proliferation: Myc function in stem cells. Trends Cell Biol. 2005;15:128-37 pubmed
- Li C, Johnson G. Rhodamine123 reveals heterogeneity within murine Lin-, Sca-1+ hemopoietic stem cells. J Exp Med. 1992;175:1443-7 pubmed
- Nygren J, Jovinge S, Breitbach M, Säwén P, Röll W, Hescheler J, et al. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat Med. 2004;10:494-501 pubmed
- Spangrude G, Heimfeld S, Weissman I. Purification and characterization of mouse hematopoietic stem cells. Science. 1988;241:58-62 pubmed
- Okada S, Nakauchi H, Nagayoshi K, Nishikawa S, Miura Y, Suda T. In vivo and in vitro stem cell function of c-kit- and Sca-1-positive murine hematopoietic cells. Blood. 1992;80:3044-50 pubmed
- Bonnet D, Dick J. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-7 pubmed
- Al-Hajj M, Wicha M, Benito-Hernandez A, Morrison S, Clarke M. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-8 pubmed
- Singh S, Hawkins C, Clarke I, Squire J, Bayani J, Hide T, et al. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401 pubmed
- Matsui W, Huff C, Wang Q, Malehorn M, Barber J, Tanhehco Y, et al. Characterization of clonogenic multiple myeloma cells. Blood. 2004;103:2332-6 pubmed
- Collins A, Berry P, Hyde C, Stower M, Maitland N. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-51 pubmed
- Kim C, Jackson E, Woolfenden A, Lawrence S, Babar I, Vogel S, et al. Identification of bronchioalveolar stem cells in normal lung and lung cancer. Cell. 2005;121:823-35 pubmed
- Noaksson K, Zoric N, Zeng X, Rao M, Hyllner J, Semb H, et al. Monitoring differentiation of human embryonic stem cells using real-time PCR. Stem Cells. 2005;23:1460-7 pubmed
- Eiges R, Schuldiner M, Drukker M, Yanuka O, Itskovitz-Eldor J, Benvenisty N. Establishment of human embryonic stem cell-transfected clones carrying a marker for undifferentiated cells. Curr Biol. 2001;11:514-8 pubmed
- Doetschman T, Eistetter H, Katz M, Schmidt W, Kemler R. The in vitro development of blastocyst-derived embryonic stem cell lines: formation of visceral yolk sac, blood islands and myocardium. J Embryol Exp Morphol. 1985;87:27-45 pubmed
- Nakano T, Kodama H, Honjo T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 1994;265:1098-101 pubmed
- Nishikawa S, Nishikawa S, Hirashima M, Matsuyoshi N, Kodama H. Progressive lineage analysis by cell sorting and culture identifies FLK1+VE-cadherin+ cells at a diverging point of endothelial and hemopoietic lineages. Development. 1998;125:1747-57 pubmed
- Höpfl G, Gassmann M, Desbaillets I. Differentiating embryonic stem cells into embryoid bodies. Methods Mol Biol. 2004;254:79-98 pubmed
- Aubert J, Dunstan H, Chambers I, Smith A. Functional gene screening in embryonic stem cells implicates Wnt antagonism in neural differentiation. Nat Biotechnol. 2002;20:1240-5 pubmed
- Noguchi H, Kaneto H, Weir G, Bonner-Weir S. PDX-1 protein containing its own antennapedia-like protein transduction domain can transduce pancreatic duct and islet cells. Diabetes. 2003;52:1732-7 pubmed
- Zhou J, Pineyro M, Wang X, Doyle M, Egan J. Exendin-4 differentiation of a human pancreatic duct cell line into endocrine cells: involvement of PDX-1 and HNF3beta transcription factors. J Cell Physiol. 2002;192:304-14 pubmed
- 8.
- Hescheler J, Fleischmann B, Lentini S, Maltsev V, Rohwedel J, Wobus A, et al. Embryonic stem cells: a model to study structural and functional properties in cardiomyogenesis. Cardiovasc Res. 1997;36:149-62 pubmed
- Boheler K, Czyz J, Tweedie D, Yang H, Anisimov S, Wobus A. Differentiation of pluripotent embryonic stem cells into cardiomyocytes. Circ Res. 2002;91:189-201 pubmed
- Bain G, Kitchens D, Yao M, Huettner J, Gottlieb D. Embryonic stem cells express neuronal properties in vitro. Dev Biol. 1995;168:342-57 pubmed
- Okabe S, Forsberg-Nilsson K, Spiro A, Segal M, McKay R. Development of neuronal precursor cells and functional postmitotic neurons from embryonic stem cells in vitro. Mech Dev. 1996;59:89-102 pubmed
- Tropepe V, Hitoshi S, Sirard C, Mak T, Rossant J, van der Kooy D. Direct neural fate specification from embryonic stem cells: a primitive mammalian neural stem cell stage acquired through a default mechanism. Neuron. 2001;30:65-78 pubmed
- Kawasaki H, Mizuseki K, Nishikawa S, Kaneko S, Kuwana Y, Nakanishi S, et al. Induction of midbrain dopaminergic neurons from ES cells by stromal cell-derived inducing activity. Neuron. 2000;28:31-40 pubmed
- Berninger B, Costa M, Koch U, Schroeder T, Sutor B, Grothe B, et al. Functional properties of neurons derived from in vitro reprogrammed postnatal astroglia. J Neurosci. 2007;27:8654-64 pubmed
- Maltsev V, Rohwedel J, Hescheler J, Wobus A. Embryonic stem cells differentiate in vitro into cardiomyocytes representing sinusnodal, atrial and ventricular cell types. Mech Dev. 1993;44:41-50 pubmed



