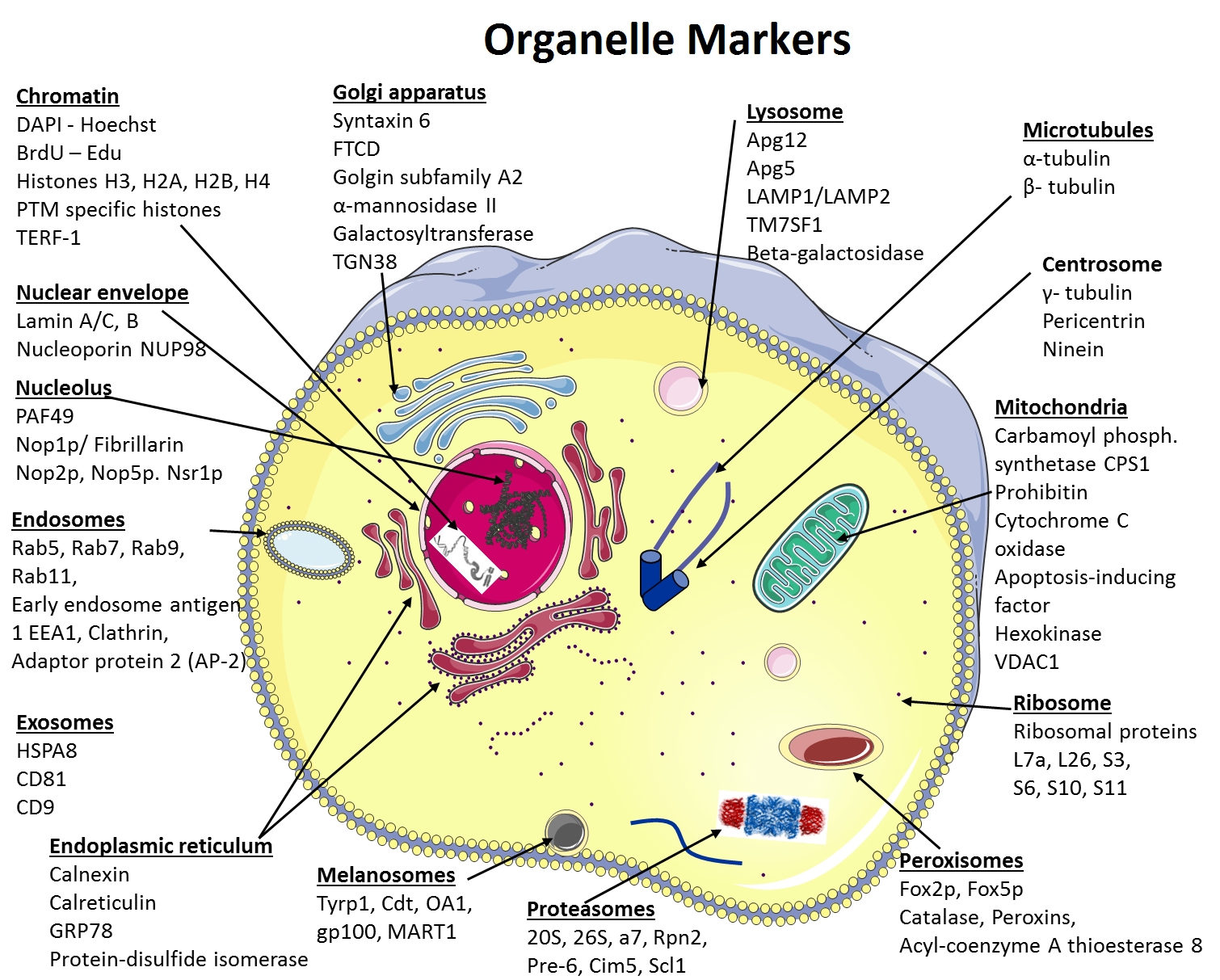
A comprehensive compilation of organelle markers.
| 蛋白 | 全称 | Uniprot编号 | 基因ID | 次数 | 排名前三的供应商 |
|---|---|---|---|---|---|
| 高尔基体 | |||||
| GM130 | 高尔基体蛋白亚科A成员2 | Q08379 | 2801 | 43 | BD (37) |
| TGN38 | 反面高尔基网融入膜蛋白2 | O43493 | 10618 | 15 | AbDSerotec (7), BD (6) |
| RCAS1 | 表达在SiSo细胞上的受体结合肿瘤抗原 | O00559 | 9166 | 5 | MBL (4) |
| alpha-甘露糖苷酶2 | Q16706 | 4124 | 4 | EMD (2), Covance (2) | |
| 突触融合蛋白6 | O43752 | 10228 | 3 | BD (3) | |
| FTCD | 亚胺甲基转移酶环化脱氨酶 | O95954 | 10841 | 0 | |
| b4Gal | beta1,4-半乳糖基转移酶6 | Q9UBX8 | 9331 | 0 | |
| 线粒体 | |||||
| AIF | 凋亡诱导因子 | O95831 | 9131 | 6 | Santa Cruz Biotechnologies(2), EMD (2), Abcam (2) |
| COX | 细胞色素C氧化酶亚基1 | P00395 | 4512 | 4 | Life Technologies (1) |
| VDAC1 | 线粒体外膜蛋白孔蛋白1 | P21796 | 7416 | 2 | Life Technologies (2), EMD (2) |
| CPS1 | 氨甲酰磷酸合成酶 | P31327 | 1373 | 1 | Abcam |
| 抑制素 | P35232 | 5245 | 1 | Thermo Fisher | |
| 己糖激酶-1 | P19367 | 3098 | 0 | ||
| 染色质 | |||||
| 组蛋白H3.1 | P68431 | 8968 | 23 | EMD (17), CST (3), Abcam(2) | |
| TERF1 | 端粒重复结合因子 | P54274 | 7013 | 2 | EMD, Sigma |
| 组蛋白H2A | Q7L7L0 | 92815 | 1 | Abcam | |
| 组蛋白H4 | P62805 | 8359 | 1 | EMD | |
| TERF2IP | 端粒重复结合因子2-相互作用蛋白1 | Q9NYB0 | 54386 | 1 | Bethyl |
| 组蛋白H2B | P33778 | 3018 | 0 | ||
| 核膜 | |||||
| 核纤层蛋白前体-A/C | P02545 | 4000 | 13 | SCBT (6), CST (2) | |
| 核纤层蛋白B1 | P20700 | 4001 | 3 | SCBT (2), EMD | |
| 核孔复合体蛋白 Nup98 | P52948 | 4928 | 0 | ||
| 核仁 | |||||
| Nop1p | 核仁纤维蛋白 | P22087 | 2091 | 7 | Abcam (5), cytoskeleton (2) |
| DNA引导核糖核酸聚合酶I亚基 RPA34 | O15446 | 10849 | 0 | ||
| Nop2p | 核糖体RNA甲基转移酶 NOP2 | P46087 | 4839 | 0 | |
| 内涵体 | |||||
| EEA1 | 早期内体抗原1 | Q15075 | 8411 | 60 | BD (41), SCBT (8), Thermo Fisher Pierce (5) |
| 网格蛋白重链1 | Q00610 | 1213 | 12 | BD (6), SCBT (2), Thermo Fisher Pierce (2) | |
| Rab5 | Ras相关蛋白 Rab5 | P20339 | 5868 | 11 | BD (9), Enzo (1), SCBT (1) |
| Rab11 | Ras相关蛋白 Rab-11A | P62491 | 8766 | 3 | SCBT, Life Tech, BD |
| Rab9 | Ras相关蛋白 Rab-9a | P51151 | 9367 | 2 | Thermo Fisher Pierce (2) |
| Rab7 | Ras相关蛋白-7a | P51149 | 7879 | 1 | SCBT |
| 网格蛋白轻链B | P09497 | 1212 | 0 | ||
| AP-2 | AP-2复合体亚基sigma | P53680 | 1175 | 0 | |
| 外来体 | |||||
| HSPA8 | Q96IS6 | 3312 | 4 | Enzo (2), Thermo Fisher Pierce (1), Abcam (1) | |
| CD81抗原 | P60033 | 975 | 3 | BD (2), SCBT (1) | |
| CD9抗原 | P21926 | 928 | 0 | ||
| 内质网 | |||||
| 钙联接蛋白 | P27824 | 821 | 28 | Enzo (16), BD (4), Thermo Fisher Pierce (3) | |
| 钙网蛋白 | P27797 | 811 | 18 | Enzo (7), EMD (4), SCBT (2) | |
| GRP78 | 葡萄糖调节蛋白78 | P11021 | 3309 | 17 | Enzo (9), BD (4), SCBT (3) |
| PDI | 蛋白二硫键异构酶(PDI) | P07237 | 5034 | 4 | Enzo (4) |
| 微管 | |||||
| alpha微管蛋白 | Q71U36 | 7846 | 32 | Sigma (19), Thermo Fisher Pierce (2), EMD (2) | |
| beta微管蛋白III(神经元微管) | Q13509 | 10381 | 14 | Sigma (11), Covance (7), EMD (3) | |
| 中心体 | |||||
| gamma微管蛋白 | P23258 | 7283 | 22 | Sigma (20), SCBT(1), Abcam (1) | |
| 中心粒旁体蛋白 | O95613 | 5116 | 5 | Covance (3), Abcam (2) | |
| ninein | Q9Y2I6 | 22981 | 0 | ||
| 肌动蛋白丝 | |||||
| 肌动蛋白alpha(平滑肌) | P62736 | 59 | 30 | Sigma (30), Dako (12), Abcam (2) | |
| 自噬体和溶酶体 | |||||
| LAMP1 | 溶酶体相关膜蛋白1 | P11279 | 3916 | 31 | DHSB (10), BD (10), SCBT (5) |
| LAMP2 | 溶酶体相关膜蛋白2 | P13473 | 3920 | 15 | DSHB (7), SCBT (3), Abcam (2) |
| LC3 | 微管关联蛋白1A/1B轻链3A | Q9H492 | 84557 | 6 | MBL (3), Abgene (2), Nanotools (1) |
| beta-半乳糖苷酶 | P16278 | 2720 | 4 | Life Tech (1), Abcam (1), Promega (1) | |
| Apg12 | ATG12 自噬相关蛋白12 | C1IDX9 | 9140 | 1 | CST |
| Apg5 | 自噬蛋白5 | Q9H1Y0 | 9474 | 1 | SCBT |
| 黑素体 | |||||
| OA1 | T细胞识别的黑素瘤抗原1 | Q16655 | 2315 | 5 | Dako (3), Covance (1), Nichirei (1) |
| Gp100 | 黑色素细胞蛋白 PMEL | P40967 | 6490 | 2 | Thermo Fisher Pierce (1), Enzo (1) |
| TYRP1 | 酪氨酸酶相关蛋白1 | Q6LES1 | 7306 | 1 | SCBT |
| Dct / TYRP2 | 酪氨酸酶相关蛋白2 | P40126 | 1638 | 0 | |
| 过氧化物酶体 | |||||
| 过氧化氢酶 | P04040 | 847 | 1 | RDI | |
| 酰基辅酶A硫酯酶8 | O14734 | 10005 | 0 | ||
| PEX3 | 过氧化物酶体发生因子3 | P56589 | 8504 | 0 | |
| 核糖体 | |||||
| rpS6 | 核糖体蛋白S6 | P62753 | 6194 | 2 | CST (2) |
| 60S核糖体蛋白L7a | P62424 | 6130 | 0 | ||
| 60S核糖体蛋白L26 | P61254 | 6154 | 0 | ||
| 蛋白酶体 | |||||
| 20S蛋白酶体alpha亚基 | P25786 | 5682 | 5 | EMD (3), Sigma (1), Affiniti (1) | |
| 蛋白酶体亚基alpha-5 | P28074 | 5693 | 0 | ||
| 26S蛋白酶调节亚基4 | P62191 | 5700 | 0 | ||
| Rpn2 | 26S蛋白酶体非ATP酶调节亚基1 | Q99460 | 5707 | 0 | |
| Cim5 | 26S蛋白酶调节亚基7 | P51665 | 5713 | 0 | |
| 有丝分裂 | |||||
| 磷酸化组蛋白H3 | P68431 | 8968 | 5 | EMD (4), CST (1) | |
| 胞质分裂 | |||||
| 极光B激酶 | Q96GD4 | 9212 | 12 | BD (9), Abcam (2), Rockland (1) | |
细胞并不只是原生质囊泡。它们含有一些细胞器与结构,每种都有其各自独特的功能。为了详细了解一个细胞器的特征及组成,通常需要先对其进行纯化。此外,表征一种新的蛋白也需要知道它的位置。使用其它一些已经定位清楚的蛋白(标记物)作为对照是一种十分有用的策略。本综述中将会讨论这些在蛋白质免疫印迹和免疫荧光中被用作标记物的蛋白。在本综述的第二部分中将会介绍一些用于亚细胞分离和细胞器纯化的方法。
高尔基体的主要功能是对大分子进行正确折叠并将其分泌到胞外环境中(通过反面高尔基进行胞吐)或在胞内环境中与其它蛋白和脂类一起运输(高尔基堆)。高尔基体也可以合成蛋白聚糖和碳水化合物。它们通常在有丝分裂中解体并在有丝分裂完成后的每个子细胞中重新组装起来 [6] 。
表达在SiSo细胞上的受体结合肿瘤抗原是一种III型跨膜高尔基体蛋白 [7] ,并且主要是特异性地定位于内质网-高尔基中间腔室和顺面高尔基网 [8] 。
主要发现于高尔基体并参与胞内囊泡的输送 [9] 。
是分子量为58 kDa且具有转移酶和脱氨酶活性的酶。它位于高尔基体并辅助波形蛋白从高尔基体开始成束。但最近也发现存在于中心体中 [10] 。
是一种高尔基体自体抗原,可能在内质网-高尔基体间的运输过程中有一定功能 [11] 。
位于高尔基体膜并参与蛋白质糖基化,负责调控N-聚糖的合成。
参与葡糖鞘脂类的生物合成,是另一种高尔基内膜标记物。

调控从反面高尔基网(分泌机制)到质膜的膜运输。使用布雷菲德菌素A处理后,高尔基堆会发生解体,反面高尔基网也会随着中心体一起瓦解。因此,TGN38染色可以区分反面高尔基网与高尔基堆。
线粒体(希腊语mitos,μίτος = 线 + chondrion,χονδρίον = 颗粒)是直径为0.5-1.0 μm的一种细胞器。由于它们以三磷酸腺苷(ATP)的形式合成能量,因此被认为是细胞的发电厂。但它们还有一些其它的功能。线粒体是由内膜、外膜、膜间腔、嵴和基质组成的,它们独立于细胞核并含有自己的DNA。在人类中,已经发现了600多种不同的蛋白质 [12] ,其中一些被用作标记物。
分子量为163 kDa,是参与尿素循环并从细胞中去除多余氨的酶的线粒体同工酶。CPS1是肝脏和肾脏线粒体的标记物。
线粒体内膜上分子量为30 kDa的蛋白,可能调控线粒体呼吸功能。它参与凋亡、细胞周期调控和衰老等活性。抑制素在细胞周期的G1期中或是用一种线粒体蛋白合成抑制剂甲砜霉素处理时丰度较高。
是线粒体内膜上的蛋白复合体 [13] 。它参与ATP合成过程中所必须的质子转运及将氧气催化为水。大多数COX亚基都可以作为很好的线粒体标记物。
是膜间腔中分子量为67 kDa的蛋白且表达广泛。在线粒体中,AIF作为一种氧化还原酶具有抗凋亡活性。然而在凋亡信号转导过程中AIF被释放到胞质中并转运至细胞核引起核凋亡。
线粒体外膜上催化醣酵解第一个步骤的100 kDa激酶。己糖激酶使己糖(一种六碳糖)磷酸化,形成磷酸己糖(例如葡萄糖变为葡萄糖-6-磷酸)。
(线粒体外膜蛋白孔蛋白1)是己糖激酶和BCL2L1的线粒体外膜受体。
有一些蛋白被用于区分不同的核结构。
DNA通过缠绕在四种核心组蛋白(H2A、H2B、H3、H4-形成一个八聚体)上进行浓缩,从而形成核小体。组蛋白H1是一种结合在较远染色质区域并使之进一步压缩的蛋白连接因子。DNA和它的组蛋白以及其它结合在上面的蛋白(用于调控转录、复制、DNA修复等)一起统称为染色质。
因此,任意一种结合DNA的燃料都可以用做染色质标记物。例如,4',6-二脒基-2-苯基吲哚(DAPI)和染料Hoechst 33258和Hoechst 33342都是常用的。溴脱氧尿苷(BrdU)是一种用于检测增殖中的细胞的合成核苷。5-乙炔基-2'-脱氧尿苷(EdU)染色也同样有效。
对于核小体形成而言所有的核心组蛋白都是必须的。因此抗组蛋白抗体主要标记染色质。组蛋白修饰特异性的抗体可以区分常染色质(例如H3K4me3和H3K36me3)和异染色质(例如H4K20me3)。磷酸化组蛋白H3也可以用于指示细胞的有丝分裂状态 [14] 。
端粒重复结合因子2-相互作用蛋白1(TERF-1、RAP1)位于端粒并调节端粒的长度。
核膜是一种将细胞核包围起来使之与胞质分离的脂双层膜结构。内膜由中间丝的网状结构即纤层组成,而外膜直接与内质网相连,因此有些相同的蛋白。核膜上的小孔组成了直径约100 nm的核孔复合物,它们将内核膜与外核膜连接在了一起并从核内或核外输入或输出蛋白。
核纤层蛋白A(74 kDa)、核纤层蛋白C和核纤层蛋白B(68 kDa)可以用抗体进行检测,从而指示核膜所在。核膜在有丝分裂中会发生解体。在凋亡过程中,核纤层蛋白A和C会被切割成40-50 kDa和28 kDa的两种片段。
核孔蛋白(NUP98)属于核孔复合物。
核仁是细胞核内的一种非膜状结构,负责转录和组装核糖体RNA。核仁的蛋白组成部分可用作标记物,例如RNA聚合酶PAF49、核仁蛋白1(Nop1p/核仁纤维蛋白)、Nop2p、Nop5p和Nsr1p。
内涵体是将分子包裹住以后将其从膜上转移至细胞其它部位的胞质室。通常,内吞的复合物(例如受体-配体)被分配到早期内涵体中,而每种成分就可以通过晚期内涵体转运到新的位点(例如溶酶体、高尔基体等)。
Rab5是Ras家族中的一种小GTP酶(24 kDa)。它从质膜穿梭至早期内涵体并通过与其它蛋白质的相互作用来调节膜泡运输及质膜与早期内涵体的融合。类似地,Rab7、Rab9和Rab11都是很好的内涵体蛋白标记物。
早期内体抗原1(EEA1)是一种与Rab5相互作用的蛋白。它是一种分子量为162 kDa的蛋白并参与内涵体运输。
负责内吞和分子转运的其它结构还有网格蛋白包被的小窝(或小泡)。这些小泡是由包装有膜受体和其它分子的蛋白质外壳所组成的。网格蛋白和衔接蛋白-2(AP-2)是网格蛋白包被小泡很好的标记物。
有时候内涵体会与质膜融合并被分泌到胞外环境中,从而形成一种分泌机制。由于外来体含有一些可作为特定疾病潜在标志物的胞质蛋白、膜蛋白以及脂类和RNA分子,因此十分重要。
HSPA8以及四跨膜蛋白CD81和CD9都是外来体的良好标志物。
内质网是一种含有许多帮助多肽正确折叠并组装蛋白复合物的分子伴侣的胞质结构。大多数内质网蛋白含有KDEL基序(赖氨酸-天门冬氨酸-谷氨酰胺-亮氨酸),并通过与内部的内质网KDEL受体发生相互作用来维持在内质网内。因此,能识别该基序的抗KDEL抗体就被用作内质网的正标记物。
是一个90 kDa的内质网内在膜蛋白,它与未折叠的蛋白结合并使其留在内质网中。
是一个在C端含有KDEL基序、分子量为48 kDa的内质网分子伴侣,与内质网中合成的单葡糖基化的蛋白结合。
葡萄糖调节蛋白78(GRP 78)含有一个C端的KDEL基序,负责内质网中蛋白复合物的组装。它对于细胞存活是必需的。
位于内质网是由于其KDEL结构域。PDI具有使未折叠蛋白中形成二硫键(S-S)等功能。
微管是由微管蛋白组成的细长丝状物。α-微管蛋白和β-微管蛋白是分子量为55 kDa且可以形成异源二聚体的球形蛋白。它们可以聚合形成圆柱状的微管。它们参与多种细胞功能,尤其是在细胞结构维持、胞内运输或是细胞分裂过程中用于分离姐妹染色单体的有丝分裂纺锤体的形成中。微管蛋白的聚合始于中心体,后者构成了间期中的微管组织中心(MTOC)和有丝分裂中的纺锤极,不同的蛋白复合物组成了微管蛋白聚合起始的支架。这些复合物包含γ-微管蛋白。每个细胞只有一份中心体,在有丝分裂时会进行复制。
针对α-或β-微管蛋白的抗体都是微管的良好标记物。
抗γ-微管蛋白抗体可以指示中心体。其它的中心体标记物还有中心粒旁体蛋白和Ninein。中心粒旁体蛋白是参与微管初始形成(成核)且分子量为220 kDa的蛋白。Ninein是参与微管成核及正端和负端加帽的中心体蛋白。
与微管类似,肌动蛋白丝是由α-或β-肌动蛋白形成的双螺旋细圆柱管。它们的动态聚合与解聚周期调节着细胞运动、细胞极化和细胞支撑。此外,一些肌动蛋白结合蛋白控制着肌动蛋白的聚合。
结合于肌动蛋白单体的抗肌动蛋白抗体或是荧光标记的能与纤维状肌动蛋白结合的毒素鬼笔环肽。
自噬体是由小的膜结构,自噬体前体,拉伸后围绕在损伤的细胞器周围形成的双层膜所构成的胞内细胞器。之后自噬体会与含有水解酶和其它降解酶的溶酶体融合以准备降解 [15] 。
Apg12和Apg5是共价相连的,并作为一个单位行使功能。因此,Apg12-Apg5结合物在拉伸过程中位于自噬体膜上。因此它是自噬过程起始的一个良好标志物。一些其它的Apg亚型调节自噬体形成及与溶酶体的融合,也能用作自噬体的标记物。
微管关联蛋白1轻链3(LC3)也位于膜上,只是完全形成后也发现存在于分离膜上。LC3在溶酶体上也有发现,只是丰度较低 [15] 。
溶酶体相关膜蛋白1和2(LAMP1;LAMP2)是溶酶体膜的组成部分,因此构成了极佳的溶酶体标志物。它们最近已经被用于证实跨膜7超族成员1(TM7SF1)是溶酶体的一种膜蛋白 [16] 。
beta-半乳糖苷酶是一种可用作为溶酶体标记物的糖苷酶。
阳离子依赖甘露糖-6-磷酸受体(M6PR)参与了溶酶体酶从高尔基体和细胞表面到溶酶体的运输过程。
主要发现于溶酶体中的约77种蛋白的完整列表可以在Lübke等人的文章中找到 [17] ,虽然并非所有的这些蛋白都被确立为标记物。
黑素体是黑素细胞、皮肤和视网膜上皮细胞的细胞器。黑素体中含有保护细胞免受有害紫外线(UV)辐射的黑色素。
黑素体的标记物有酪氨酸酶、Tyrp1、Dct、OA1、gp100和MART1 [18] 。
过氧化物酶体是进行诸如脂肪酸β-氧化等氧化反应及预防过氧化物的结构 [19] 。
Fox2p和Fox5p是过氧化物酶体的膜受体。
过氧化氢酶是一种保护细胞免受过氧化氢毒性的过氧化物酶体蛋白。
酰基辅酶A硫酯酶8属于一组催化酰基辅酶A水解成自由脂肪酸及辅酶A(CoASH)的酶,能够调节胞内酰基辅酶A、自由脂肪酸和CoASH的水平。
过氧化物酶体生成蛋白(由24种基因组成的一类蛋白)是过氧化物酶体形成中不可分割的一部分。
核糖体是蛋白质和RNA分子的分子复合物(核糖核蛋白),蛋白质在上面合成。它们由一个40S小亚基和一个60S大亚基组成。一些核糖体特异性的蛋白可作为其标志物。
针对核糖体蛋白L7a、L26(60S亚基的成分)、 S3、S6、S10、S11(40S亚基)的抗体是典型的例子。
蛋白酶体是多蛋白复合物,其功能是通过蛋白水解来降解蛋白。每个蛋白酶体由四个堆在一起的环形成一个中央孔,即核心。蛋白水解酶中一个由七个蛋白(β亚基)构成的复合物形成了内部的两个环,而七个α亚基形成了蛋白进入并达到核心的入口。
蛋白酶体中的20S蛋白酶体亚基 [20] 、26S蛋白酶体亚基、α7和Rpn2 [21] ,Pre6、Cim5和Scl1 [22] 都是常用的蛋白酶体标记物。
组蛋白H3在丝氨酸10处发生磷酸化(H3S10ph),并且对于有丝分裂的起始是必须的 [14] 。
对于研究特定胞内结构、细胞器或蛋白,抑或是分析这些大分子结构间的相互关联而言,将不同胞内区室相互分开是一个十分重要的步骤。亚细胞分离就是利用诸如浮力密度、表面电荷密度、尺寸及大小等一个或多个不同的属性,主要在高粘度介质中于4oC进行差速离心来实现的。用于差速离心的介质主要是蔗糖、甘露糖醇、甘油、菲可400(一种蔗糖多聚物),Percoll(胶体硅)和碘克沙醇(OptiPrep)。蔗糖由于其廉价所以被广泛使用,但是这些介质都有其各自的优势与局限性,Harford和Bonifacino(2011)对此已经做了详细的讨论。这里主要会讨论这些方法,并且重点关注那些大多数实验室都能便于操作且不太费时的方法,因为能够进行快速回收是至关重要的。同样也可以使用凝胶过滤、亲和层析、电泳或选择性密度位移扰动。现有操作流程中条件的变化取决于细胞器、组织或细胞类型以及所使用的设备。为了了解每种操作过程的全部细节,强烈推荐阅读引用的参考文献。最后,分离的纯度与产量应当在整个操作过程中通过每种收集的组分中不同标记物的检测来进行评估。
下面是最常用的细胞器分离方法。使用大鼠肝脏进行分离的方法已经详细讨论过了,并且很容易在文献中找到,因此本综述这一部分的重点是其它的模式体系。
胞质、核质与染色质组分可以很容易地从培养的细胞团中得到 [1] 。细胞被重悬于含有0.34 M蔗糖、10%甘油、低浓度温和去垢剂(0.1% Triton X-100)及K+和Mg2+(防止核破裂)的缓冲液中。通过低速离心就可以使核成团而上清就被保留下来作为胞质组分。之后,细胞核裂解于含有螯合剂EDTA与EGTA的缓冲液中,不可溶的染色质就可以通过低速离心来使之成团,而上清即为核质组分 [1] (图3)。
有些研究者会进行“快速而粗糙”的染色质制备,其上会结合有胞质/核质蛋白。这可以通过在含有1% Triton X-100的裂解缓冲液中裂解细胞来进行操作。在该缓冲液中,染色质与一些细胞骨架结构是不溶的,可以通过离心来进行回收。沉淀块可以重悬于所选的缓冲液,例如用于SDS PAGE的Laemmli [2] 。
1.将长成单层或悬浮状态的细胞团在含有MgCl2和KCl的匀浆缓冲液进行均质化。然后将蔗糖加至0.25 M,通过低速离心(1000 g)就可以使核成团。以5000 g对上清进行二次离心就会使线粒体沉淀。沉淀块重悬于含有蔗糖和Mg2+的溶液中并在杜恩斯匀浆器中轻柔地抽几下。最后于5000 g的离心步骤会使线粒体富集,然后可以重悬于含有0.25 M蔗糖的Tris缓冲液或利于后续分析的缓冲液(例如Laemmli) [3] 。
2.酵母细胞要用酵母裂解酶处理使坚硬的外侧细胞壁破碎,然后产生原生质球形体,再用山梨醇缓冲液清洗。沉淀块重悬于含有0.6 M甘露醇的匀浆缓冲液中并在杜恩斯匀浆器中抽几下使细胞裂解。细胞核通过低速离心去除而含有胞质的上清用定角转子于6500 g离心使线粒体成团。
此外还有些利用密度梯度分离的操作流程可以制备更纯的线粒体组分,但是由于这些操作流程更加费时而被避用。尽管用差速离心得到的组分中会有溶酶体和过氧化物酶体的“污染”,它们仍是可供选择的方法。因此所想要的纯度决定了最适用的方法。例如想要进行代谢研究时会优选差速离心;或者在研究一种蛋白的精确位置时或必须需要最纯的样品时,比如蛋白组学中,利用密度梯度进行制备通常更为合适。
Smith等人使用的方法 [4] 。通过2,000 g的离心得到的去核上清再于20,000 g离心30分钟。将含有过氧化物酶体和线粒体的沉淀块重悬于MS缓冲液中,然后置于溶在MS缓冲液的Nycodenz梯度(17%, 25%, 35%, 50%)顶端。于116,000 g离心2小时后过氧化物酶体将位于组分2-8。
要进一步分离过氧化物酶体膜相关蛋白可以通过Fujiki等人(1982)和Nuttley等人(1990)的方法来实现 [4] 。将上述提到的20,000 g离心得到的沉淀块重悬于10倍体积的Ti8缓冲液(Tris 10mM,pH 8.0和PINS)中后于200,000 g分离1小时。含有过氧化物酶体膜的沉淀块再次重悬于Ti8缓冲液中。加入0.1 M碳酸钠后继续于200,000 g离心1小时后,过氧化物酶体膜就与结合在上面但并非整合在膜上的蛋白分开了。
溶酶体、线粒体和过氧化物酶体在蔗糖梯度中的密度十分相似,因此要选择避免使用该方法。在Percoll中溶酶体更为致密,几乎或完全没有其它细胞器的污染。
清洗过的细胞在含有0.25 M蔗糖的3 mL缓冲液中用匀浆器抽5次,进行均质化。800 g离心10分钟后会使完整的核及碎片成团,将上清存放于冰上。细胞核沉淀块重悬于0.5 mL同样的缓冲液并像之前一样再次离心,将所得上清与第一次离心的上清混在一起。在该溶液中,将Percoll储存液(0.25%蔗糖)和牛血清白蛋白(BSA)分别加至终浓度为20%(注意:可以增加至27%-35%)与0.4%(终体积为4.5 mL),并于36,000 g离心30分钟(注意:15,000 g离心60分钟至62,500 g离心40分钟间变化均可)。使用梯度卸载器将梯度收集成0.4 mL的组分,溶酶体通常靠近梯度的底部。为了更好地溶解溶酶体并增加回收率,在100,000 g离心1-2小时前加入NP-40至终浓度为0.5%。但是如果想要完整的细胞器的话,例如要进行代谢测试时,NP-40应当避免 [23] 。
Kushimoto等人与Basrur等人使用的是溶于HEPES缓冲液的不连续蔗糖梯度 [18, 24] 。更具体地来讲,细胞裂解物重悬于2 M蔗糖并放于一个不连续蔗糖梯度(1.0、1.2、1.4、1.5、1.6、1.8、2.0 M)的顶部。100,000 g离心1小时候,早期阶段的黑素体(I期和II期)从1.0-1.2 M的蔗糖区域中回收出来。经富集的组分通过Octopus-PZE FFE设备以2.0 ml/hr进行自由流电泳(FFE),从而进一步分成富含酪氨酸酶和富含蛋白的组分。使用溶于三乙醇胺、pH 7.4的0.25 M蔗糖,以1000–1100 V及≈110–125 mA进行FFE,洗脱流速为3–4 ml/min [24] 。该操作过程可以产生高度富集的黑素体样品以用于蛋白质组学分析,通过该分析可以确定>60种黑素体蛋白 [18] 。
另一种制备高纯度黑素体组分的操作流程也是由同样的研究者发明的。溶于2 M蔗糖的细胞裂解物加至不连续蔗糖梯度的底部。100,000 g离心1小时后,将从蔗糖浓度约为1 M的区域中回收到的早期阶段黑素体再加至0.8、1.0和1.2 M的蔗糖延伸梯度中央并再次像之前那样离心。这一附加的步骤会彻底去除线粒体“污染”。
晚期阶段的黑素体(III期和IV期)也可以从1.8 M的蔗糖层中回收出来,它们因含有较多的黑色素而较重。
Welton 等人已经从膀胱癌细胞系HT1376中提取到了外来体 [25] 。通过轻微的离心去除细胞(400 g离心10分钟)与细胞碎片(2000 g离心15分钟后10,000 g再离心30分钟)后将上清置于氧化氘(D2O或重水)中30%蔗糖垫的顶部进行高速离心(100,000 g离心2小时)。用PBS清洗后外来体就在沉淀块中。
Hogan用以下的方法从尿液中分离到了外来体 [26] 。在150,000 g中离心1小时之前,尿液样品先于15,000 g离心进行预清除并且经过8 μm尼龙过滤器处理。沉淀块中含有外来体样的囊泡以及Tamm-Horsfall蛋白(THP或尿调节素)这种尿液中的主要蛋白。为了去除THP,将样品置于溶于重水、pH 6.0的不连续蔗糖梯度(5-30%)顶部。于200,000 g离心24小时后将缓冲区域收集到14个相同的组分中。每个组分用PBS稀释5倍至10倍后于150,000 g再离心1小时,将含有纯净外来体的沉淀块进行回收。
组蛋白是胞内环境中最基本的蛋白质。这里所说的是从细胞或非洲爪蟾提取物中富集组蛋白的要点。将完整的、已经纯化的细胞核(就像之前的讨论那样)重悬于0.2 M硫酸(H2SO4)并4oC离心后大部分的细胞蛋白都沉淀了,而组蛋白仍然是溶于溶液中的,可以用16,000 g离心15分钟进行回收 [27] 。或者也可以用2.5 M NaCl孵育的办法提取染色质化的组蛋白。
Chen等人使用的高尔基体膜分离方法 [6] 。将用含有0.5 M蔗糖的缓冲液制备的肝脏组织匀浆置于0.86 M蔗糖的顶部,然后再将0.25 M蔗糖覆盖其上。于103,800 g离心60分钟后,从0.5-1.3 M的界面间收集膜并调节至0.5 M蔗糖。
中心体可以从粘附的上皮培养细胞中分离到,但是产量并不多(Andersen使用了20多亿的细胞(2 x 109) [28] )。细胞核通过低渗裂解去除而中心体则通过两个离心步骤来获取。首先置于50%蔗糖垫离心,然后用40%、50%和70%的蔗糖梯度进行离心。
Moritz等人按照如下操作从果蝇胚胎中分离到了中心体:生长至3.5小时的胚胎匀浆(溶于BRB80缓冲液+100 mM KCl及14%的蔗糖)于1,500 g离心10分钟将脂类去除。上清中加入0.1-0.5% Triton X-100及50%蔗糖(终浓度)后被加至蔗糖梯度(4 mL 55%的与3 mL 70%的)上,以用于分离中心体。大多数中心体聚集于70%蔗糖垫的顶部 [29] 。
移动中的细胞会在一侧形成一种延伸物,从而粘附于新位点并随后将其余的细胞体拉至新位点。这种延伸物就被称为伪足。Klemke及其同事 [30] 已经开发了一种在趋化剂响应过程中从细胞体中分离伪足的方法。这是利用6孔或24孔平板中的Transwell迁移室来实现的。简要地来说,细胞粘附于孔径为3微米的滤膜上侧。完整细胞是无法通过这么小的孔的。但是当细胞感知到置于下方区域的趋化剂时,形成的伪足就可以经过并附着于滤膜的下侧。之后将细胞固定,伪足或细胞体可以用选择的缓冲液裂解并收集 [31] 。
Song等人已经从小鼠肝脏中进行了亚细胞分离,该方法经过一些修改后也可以用于其它组织 [5] 。图4中的图表总结了整个操作流程。简要来说,肝脏匀浆于1,000 g离心10分钟后分成沉淀快(P1)与可溶部分(S1)。
悬浮于蔗糖终浓度为1.8 M的缓冲液(缓冲液的完整配方需要读者参考原始出版物)中的P1于70,900 g离心90分钟后会形成可供储存的含有肝脏细胞核的沉淀块(P2)以及0.25-1.8 M界面间的可溶性组分(S2)。S2重悬于0.25 M蔗糖后于1,200 g离心10分钟,含有粗制质膜的沉淀块进一步悬浮于蔗糖终浓度为1.45 M的缓冲液中并于68,400 g离心60分钟。0.25-1.45 M蔗糖中的可溶性组分加入含有0.25 M蔗糖的缓冲液后再于17,600 g离心10分钟。沉淀块重悬于蔗糖终浓度为1.35 M的缓冲液中并于230,000 g离心60分钟。将0.25-1.35 M间的组分回收后用0.25 M蔗糖稀释并于40,000 g再次离心。之后的沉淀块含有纯化的质膜蛋白,可以储存起来。
可溶性组分S1于8,000 g再次离心。这会形成含有粗制线粒体的不可溶组分(P5)和含有内质网(轻微体和重微体)及高尔基复合物的可溶性组分(S5)。
清洗后,P5重悬于含有25% Nycodenz的12 mL溶液中,然后置于非连续Nycodenz梯度(5 mL 34%的以及8 mL 30%的)的顶部并覆盖上8 mL 23%及3 mL 20%的Nycodenz。52,000 g离心90分钟后,从25-30%的界面间回收线粒体。在15,000 g离心20分钟前,将该组分收集后稀释至终浓度含200 mM甘露醇及50 mM蔗糖的缓冲液。进而将得到的含有纯线粒体的沉淀块清洗后储存起来。
可溶性组分S5于34,000 g离心30分钟后得到沉淀块(P6)与含有轻微体的可溶性组分(S4)。S4于124,000 g离心后将细胞质从微体(沉淀块)中分离出来并储存。P6与之前离心得到的轻微体混合后稀释至终浓度含0.25 M蔗糖及0.015 M CsCl的缓冲液中。将该溶液置于1.3 M蔗糖溶液顶部并于237,000 g离心2小时。这会使粗面内质网(沉淀块)与0.25-1.3 M界面处的滑面内质网分开。该可溶性组分用0.25 M蔗糖1:1稀释后于124,000 g离心60分钟。将滑面内质网从沉淀块中回收出来并储存 [5] 。
如果没有文献引用,蛋白质功能的信息主要来自于UniprotKB数据库、Cell Signaling及Abcam。
- Granell S, Baldini G, Mohammad S, Nicolin V, Narducci P, Storrie B, et al. Sequestration of mutated alpha1-antitrypsin into inclusion bodies is a cell-protective mechanism to maintain endoplasmic reticulum function. Mol Biol Cell. 2008;19:572-86 pubmed
- Lipp J, Hirota T, Poser I, Peters J. Aurora B controls the association of condensin I but not condensin II with mitotic chromosomes. J Cell Sci. 2007;120:1245-55 pubmed
- Song Y, Hao Y, Sun A, Li T, Li W, Guo L, et al. Sample preparation project for the subcellular proteome of mouse liver. Proteomics. 2006;6:5269-77 pubmed
- Nakajima K, Ono K, Nishikawa S, Hieda W, Yoshida T. Interconversion of molecular size of DNA polymerase from Rauscher leukemia virus. Bibl Haematol. 1975;:603-5 pubmed
- Bock J, Lin R, Scheller R. A new syntaxin family member implicated in targeting of intracellular transport vesicles. J Biol Chem. 1996;271:17961-5 pubmed
- Hagiwara H, Tajika Y, Matsuzaki T, Suzuki T, Aoki T, Takata K. Localization of Golgi 58K protein (formiminotransferase cyclodeaminase) to the centrosome. Histochem Cell Biol. 2006;126:251-9 pubmed
- Weide T, Bayer M, Koster M, Siebrasse J, Peters R, Barnekow A. The Golgi matrix protein GM130: a specific interacting partner of the small GTPase rab1b. EMBO Rep. 2001;2:336-41 pubmed
- Taylor S, Fahy E, Zhang B, Glenn G, Warnock D, Wiley S, et al. Characterization of the human heart mitochondrial proteome. Nat Biotechnol. 2003;21:281-6 pubmed
- Ostermeier C, Iwata S, Michel H. Cytochrome c oxidase. Curr Opin Struct Biol. 1996;6:460-6 pubmed
- Mizushima N, Ohsumi Y, Yoshimori T. Autophagosome formation in mammalian cells. Cell Struct Funct. 2002;27:421-9 pubmed
- Basrur V, Yang F, Kushimoto T, Higashimoto Y, Yasumoto K, Valencia J, et al. Proteomic analysis of early melanosomes: identification of novel melanosomal proteins. J Proteome Res. 2003;2:69-79 pubmed
- Purdue P, Lazarow P. Peroxisome biogenesis. Annu Rev Cell Dev Biol. 2001;17:701-52 pubmed
- Enenkel C, Lehmann A, Kloetzel P. Subcellular distribution of proteasomes implicates a major location of protein degradation in the nuclear envelope-ER network in yeast. EMBO J. 1998;17:6144-54 pubmed
- Graham J. Isolation of lysosomes from tissues and cells by differential and density gradient centrifugation. Curr Protoc Cell Biol. 2001;0:Unit 3.6 pubmed
- Kushimoto T, Basrur V, Valencia J, Matsunaga J, Vieira W, Ferrans V, et al. A model for melanosome biogenesis based on the purification and analysis of early melanosomes. Proc Natl Acad Sci U S A. 2001;98:10698-703 pubmed
- Shechter D, Dormann H, Allis C, Hake S. Extraction, purification and analysis of histones. Nat Protoc. 2007;2:1445-57 pubmed
- Andersen J, Wilkinson C, Mayor T, Mortensen P, Nigg E, Mann M. Proteomic characterization of the human centrosome by protein correlation profiling. Nature. 2003;426:570-4 pubmed
- Moritz M, Braunfeld M, Fung J, Sedat J, Alberts B, Agard D. Three-dimensional structural characterization of centrosomes from early Drosophila embryos. J Cell Biol. 1995;130:1149-59 pubmed
- Wang Y, Ding S, Wang W, Yang F, Jacobs J, Camp D, et al. Methods for pseudopodia purification and proteomic analysis. Sci STKE. 2007;2007:pl4 pubmed
- 来邦网
- 英文来邦
- 基因
- ACOT8
- AIF
- AIM-1
- AP2S1
- ATG12
- ATG5
- B4GALT6
- Bip
- CD3EAP
- CD81
- CD9
- CLTB
- COX-1
- CPS1
- 网格蛋白重链
- DCT
- 早期内涵体抗原1
- FTCD
- GLB1
- GM130
- HIST1H2BB
- HIST1H3F
- HIST1H4A
- HIST3H2A
- HK1
- Hsc70
- LAMP-1
- LC3
- Lamp-2
- MLANA
- NINL
- NOP2
- NUP98
- PEX3
- PMEL
- PSMA1
- PSMB5
- PSMC1
- PSMD1
- PSMD7
- RAB7A
- RAB9A
- RCAS1
- RPL7A
- 核糖体蛋白6
- Rab11
- Rab5
- TERF2IP
- TGN46
- TRF1
- TUBA1A
- Ⅲ型β微管蛋白
- TYRP1
- VDAC1
- 钙联接蛋白
- 钙网蛋白
- 过氧化氢酶
- fibrillarin
- γ-微管
- 核纤层蛋白A/C
- 核纤层蛋白B
- 甘露糖苷酶II
- pericentrin
- prohibitin
- 蛋白质二硫键异构酶
- 核糖体蛋白L26
- 平滑肌肌动蛋白
- syntaxin 6