本文全面地总结了实验室使用的蛋白酶和蛋白酶抑制剂,包括正式文献中引用的蛋白酶抑制剂或其混合物的调研结果。
A comprehensive review of proteases and protease inhibitors commonly used in laboratory experiments, including survey results based on formal publications citing the applications of protease inhibitors or protease inhibitor cocktails.
| 生物体 | 蛋白酶数目 |
|---|---|
| 大肠杆菌Escherichia coli | 623 |
| 酿酒酵母Saccharomyces cerevisiae | 122 |
| 毕赤酵母Pichia pastoris | 103 |
| 智人Homo sapiens | 703 |
因此很有必要采取措施阻止蛋白质纯化过程中的水解作用,这样才能分离出完整的功能化蛋白质用于实验研究。蛋白酶抑制剂常用于这类研究,所用抑制剂的种类取决于所需要抑制的蛋白酶的种类。
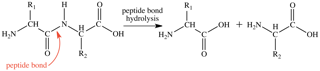

- 丝氨酸蛋白酶通过由丝氨酸、组氨酸和天冬氨酸残基组成的催化三联体起作用。
- 半胱氨酸(硫醇)蛋白酶含有组氨酸和半胱氨酸残基组成的催化二元体。 半胱氨酸进行亲核攻击来启动肽键水解。
- 天冬氨酸蛋白酶含有两个天冬氨酸残基组成的催化二元体。
- 金属蛋白酶需要锌离子(偶尔是其它二价金属离子),金属离子通过三个氨基酸与蛋白质配位以改变蛋白特性。金属离子能激活水分子,使它可以对羰基碳进行亲核攻击来破坏肽键。
内切蛋白酶特异地识别某些或某些类型氨基酸。不仅仅是形成肽键的氨基酸非常重要,相邻残基也在特异性中起作用。这种识别是由特异性口袋介导的,它是蛋白酶内活性位点周围的区域,比其它区域能更有利地结合一些氨基酸侧链。下面列出了一些最常见的蛋白酶特异性。

- 胰蛋白酶样蛋白酶主要在精氨酸或赖氨酸的羧基侧切割蛋白质(除非该残基在脯氨酸后面)。
- 胰凝乳蛋白酶样蛋白酶优先在大芳香族残基(色氨酸、酪氨酸或苯丙氨酸)的羧基侧切割蛋白质。
- Caspase样蛋白酶主要在天冬氨酸的羧基侧切割,但果蝇中的一个caspase也被证明在谷氨酸的羧基侧切割 [10] 。
- 弹性蛋白酶样蛋白酶主要在小脂肪族氨基酸(甘氨酸、丙氨酸或缬氨酸)的羧基侧切割。
蛋白酶抑制剂是阻断蛋白酶活性的分子,通常作用于具有相似作用机制的多类蛋白酶。蛋白酶抑制剂可以是蛋白、多肽或者小分子。天然蛋白酶抑制剂通常是蛋白或多肽。实验研究或药物开发中使用的蛋白酶抑制剂通常是合成的多肽类或者是小分子。许多不同的蛋白酶抑制剂可直接购买,可用于体外和体内测试以及蛋白质纯化的实验。
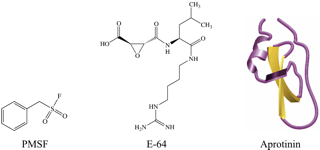
蛋白酶抑制剂能通过多种方式抑制蛋白酶的作用。这些抑制剂可以根据它们抑制的蛋白酶的类型及其抑制机制进行分类。虽然蛋白酶抑制剂通常根据它们抑制的蛋白酶的类型进行商业销售,理解抑制剂的各种作用机制对于全面理解抑制作用和开发治疗用蛋白酶抑制剂非常重要。可逆抑制剂通常通过多种非共价相互作用与蛋白酶结合,而抑制剂本身不发生反应。这些抑制剂可以通过稀释或透析去除。可逆抑制剂包括竞争性抑制剂、不竞争性抑制剂和非竞争性抑制剂。
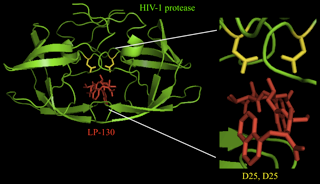
- 竞争性抑制剂与蛋白酶的活性位点结合,与底物竞争以结合活性位点残基。 例如,抑肽酶是一种竞争性抑制剂,能抑制许多丝氨酸蛋白酶 [11] 。竞争性抑制剂通常在结构上与天然底物的过渡态相似。底物过渡态是一个与酶结合最紧密的结构。因此,模拟该结构的化合物与酶结合的强度大于(在初始状态下的)底物,并且正常的酶促反应不能进行。例如LP-130就是这种过渡态类似物,它是一种HIV-1蛋白酶抑制剂,如图5所示。
- 不竞争性抑制剂仅跟与底物结合的蛋白酶结合。已确定HIV-1蛋白酶 [12] 和西尼罗河病毒的NS2B-NS3蛋白酶 [13] 的抑制剂以不竞争性方式发挥作用。
- 非竞争性抑制剂能以相似的亲和力与蛋白酶(无论其是否结合底物)结合,并通过变构机制抑制蛋白酶活性。来自大豆的胰蛋白酶抑制剂BBI [14] 和炭疽致死因子蛋白酶抑制剂氨基糖苷 [15] 都是非竞争性抑制剂。
可逆抑制剂通过形成共价键特异地改变特定目标蛋白酶的活性位点发挥作用。一旦与抑制剂结合,蛋白酶活性位点被改变而无法进行肽键水解。一些抑制剂无法与蛋白酶共价结合,但它们相互作用的亲和力高而无法轻易去除。自杀抑制剂,通常是底物的类似物,是一种与蛋白酶共价结合的不可逆抑制剂。例如serpin家族的蛋白质就是一种自杀蛋白酶抑制剂,其在血液凝固和炎症中起作用。图6是与serpin相互作用的丝氨酸蛋白酶(胰蛋白酶)的晶体结构。serpin中的环作为底物类似物。胰蛋白酶活性位点中的丝氨酸残基形成对底物类似物的羰基碳的亲核攻击,从而诱导了酶的构象变化,这对剩下的肽键水解反应不利。因此,serpin保持与蛋白酶共价结合,使得该酶不能再与底物结合。

蛋白酶抑制剂可以单独购买,也能以含有适当相对量的多种蛋白酶抑制剂的浓缩混合物购买。对于需要单一蛋白酶抑制剂用于已提纯蛋白质的水解测试时,单独的蛋白酶抑制剂是理想选择。通常,酶测试需要对照以表明目的酶正在发挥可监测的作用,因此,加入一个特定的蛋白酶抑制剂足以充当对照。当被纯化的蛋白是蛋白酶时,单独的蛋白酶抑制剂也是理想选择。这些情况下,功能蛋白的存在及其纯度通常通过酶测试评价。对于这种类型的纯化,除了目标蛋白酶的抑制剂,多种蛋白酶抑制剂均可添加。表2列出了一些常用于蛋白纯化的蛋白酶抑制剂。其中大多数对一种或多种蛋白酶具有广泛抑制作用。
| 抑制 | 可逆性 | 优缺点 | |
|---|---|---|---|
| AEBSF | 丝氨酸蛋白酶 | 不可逆 | 183 Da的AEBS 基团能共价修饰一些氨基酸残基,导致质谱和凝胶电泳出现问题 与其它丝氨酸蛋白酶抑制剂相比在水溶液中稳定 毒性低,可用于细胞及活体动物实验。 |
| 易肽酶Aprotinin | 丝氨酸蛋白酶 | 可逆 | 低离子强度下可粘附于透析袋和柱基质上 可荧光标记而不会影响抑制活性 在pH<3或pH>10时从蛋白酶解离。 |
| Bestatin | 一些氨肽酶 | 可逆 | 水溶液中稳定性低。 |
| E-64 | 半胱氨酸蛋白酶 | 不可逆 | 可与基质偶联用于半胱氨酸蛋白酶的亲和纯化 [16] 水溶液中非常稳定 特异性高(不影响其它半胱氨酸残基) 可渗透细胞,毒性低,可用于活体研究。 |
| EDTA/EGTA | 金属蛋白酶 | 可逆 | 不可用于金属螯合层析 不可用于二维凝胶电泳 水溶液中易溶且很稳定。 |
| GM 6001 | 基质金属蛋白酶 | 可逆 | 可活体注射,例如,可每天以100 µg/g的剂量腹腔注射小鼠 [17] |
| Leupeptin | 丝氨酸/半胱氨酸蛋白酶 | 可逆 | 工作浓度下稳定性低 不可渗透细胞 影响蛋白浓度测试。 |
| Pepstatin | 天冬氨酸蛋白酶 | 可逆 | 不溶于水溶液 稳定性高。 |
| PMSF | 丝氨酸蛋白酶 | 不可逆 | 神经毒素,需小心操作 水溶液中溶解度有限 水溶液中很不稳定。 |
蛋白酶抑制剂混合物因其可靠性和可重复性而常被使用。混合物含有适当相对量的多种蛋白酶,无需反复试验来确定所需抑制剂的类型和用量。跟多种不同溶液相比,它们只需一种溶液,这样能最小化人为和移液误差的可能性。混合物可以液态和固态形式存在。
Rochec Omplete片剂(图7,表3)是最常用的蛋白酶抑制剂混合物之一。将这些片剂加入特定体积的缓冲液中用来抑制大量的蛋白酶。已经证明,Roche cOmplete片剂能够成功地抑制来自许多生物(包括大肠杆菌、酵母、昆虫和哺乳动物)的裂解物中广泛的蛋白酶 [18] 。这些片剂份有或无EDTA两种。
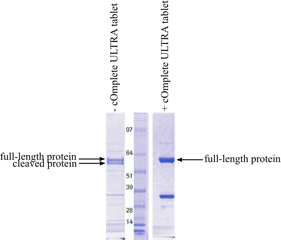
图8显示了添加和不添加Roche cOmplete ULTRA(不含EDTA)蛋白酶抑制剂混合物片剂纯化的蛋白质。在没有蛋白酶抑制剂的情况下,完整蛋白质的产量小于有蛋白酶抑制剂时产量的一半。 将蛋白酶抑制剂片剂加入指定体积的缓冲液中,片剂溶解后缓冲液中每种蛋白酶抑制剂的浓度可以达到适当的水平。添加蛋白酶抑制剂片剂非常方便,因为不涉及移液问题。在需要非常少量缓冲液的情况下,为了避免浪费过量缓冲液,液态蛋白酶抑制剂混合物可能更适合,因为片剂需要制备固定体积的溶液。Roche也销售单一的蛋白酶抑制剂。 EMD Millipore销售许多各种用途的Calbiochem蛋白酶抑制剂混合物。他们的网站提供这些混合物的成分,可以帮助消费者根据用途选择最适合的产品。既有抑制多种类型蛋白酶(蛋白酶抑制剂混合物套装 I-VIII)的混合物销售,也有抑制同一类型里不同蛋白酶(丝氨酸蛋白酶抑制剂混合物套装I)的混合物销售。它们通常以DMSO溶液或冻干粉末形式存在,冻干粉可以经过重构制备浓缩的储备液。Thermo Scientific销售蛋白酶抑制剂混合物的溶液和片剂。Halt蛋白酶抑制剂混合物是一种100X溶液,在4℃时稳定。它是溶于DMSO的AEBSF、抑肽酶、bestatin、E-64、亮抑酶肽和胃蛋白酶抑制剂A的混合物。小瓶装的EDTA可用作金属蛋白酶抑制。还有片剂的蛋白酶抑制剂组合(添加或不添加EDTA)销售。 G-Biosciences销售FOCUS™ ProteaseArrest™,这是一种可用于质谱和二维凝胶电泳的蛋白酶抑制剂混合物。这种蛋白酶抑制剂有广泛的抑制作用,还可添加EDTA抑制金属蛋白酶。Recom ProteaseArrest™是专门用于纯化在细菌中表达的组氨酸标记蛋白质的混合物。其它来自G-Biosciences的ProteaseArrest™配方可用于分离来自不同生物体的蛋白质。根据生物体内不同蛋白酶的相对含量,这些配方中抑制剂的含量也相应不同。类似地, Sigma-Aldrich也销售蛋白酶抑制剂混合物,据报道分别适用于哺乳动物组织/细胞提取物、植物组织/细胞提取物、真菌/酵母细胞提取物和哺乳动物分泌蛋白。许多其它公司也独自销售蛋白酶抑制剂,既有混合物又有多种单独抑制剂的套装。这些套装可用于确定哪种蛋白酶抑制剂适用于某种应用。当商业抑制剂混合物中的某一组分会干扰目的蛋白或下游应用时,这些套装也很有用。Sigma Aldrich、GE Healthcare、Promega、Cell Signaling Technology、Clontech和Santa Cruz Biotechnology等公司也销售各种形式的蛋白酶抑制剂。
| 供应商 | 文献数目 | 样本参考文献 | |
|---|---|---|---|
| 蛋白酶抑制剂混合物 protease inhibitor cocktail | Roche | 212 | #11836145001 [17, 19] ; #11873580001 [20] |
| Sigma | 70 | [21, 22] | |
| Calbiochem | 9 | [23, 24] | |
| Pierce | 9 | [25-27] | |
| Boehringer | 3 | [28, 29] | |
| Nacalai Tesque | 3 | [30, 31] | |
| EDTA | Sigma | 14 | [32, 33] |
| Calbiochem | 3 | [34-36] | |
| Amresco | 2 | [37, 38] | |
| STEMCELL Technologies | 2 | [39, 40] | |
| 易肽酶 aprotinin | Sigma | 13 | [41-47] |
| leupeptin | Sigma | 12 | [41, 43, 44, 48-50] |
| Roche | 2 | [51, 52] | |
| EGTA | Sigma | 7 | [44, 53-58] |
| Calbiochem | 2 | [35, 59] | |
| pepstatin | Sigma | 6 | [41, 43, 54, 60-62] |
| PMSF | Sigma | 18 | [37, 63-68] |
| Roche | 3 | [69-71] | |
| AEBSF | Sigma | 2 | [54, 72] |
| 蛋白酶和磷酸酶抑制剂混合物 protease and phosphatase inhibitor cocktails | Sigma | 6 | [60, 73-77] |
| Roche | 7 | [17, 78-83] | |
| Pierce | 6 | [55, 84-88] | |
| Calbiochem | 3 | [89, 90] |
选择合适的蛋白酶抑制剂需要考虑很多因素。最重要的考虑是蛋白酶抑制的目的:组织蛋白在纯化过程中水解、实验对照组中抑制纯化的酶还是用于生物体内来影响生理过程。以下是使用蛋白酶抑制剂时需要考虑的一些主要问题。
应用在决定蛋白酶种类中起主要作用。在体外和体内测试中,蛋白酶抑制剂的选择取决于所研究的特定的酶或生理过程。对于酶测定,抑制剂不能干扰检测方法。只要抑制是可逆的并且可用另一种检测方法(例如elisa),且在最终制剂中没有抑制剂,纯化期间靶蛋白被抑制可能无关紧要。需要注意,一些蛋白酶抑制剂对蛋白酶没有特异性。例如,PMSF不可逆地抑制许多而非全部丝氨酸水解酶家族成员。这个家族虽然包括胰蛋白酶和胰凝乳蛋白酶等蛋白酶,但也含有大量其他水解非蛋白质底物的酶(例如乙酰胆碱酯酶、酰基辅酶A水解酶和脂肪酶) [91-93] 。对于生物体内研究,抑制剂必须是细胞可渗透的,高度特异性的和无毒的。对于利用蛋白酶的广泛抑制性辅助纯化完整的功能性蛋白,通常需要多种蛋白酶。
许多蛋白酶抑制剂的储备液和工作液不能长时间稳定保存。根据供应商的说明制备溶液非常重要,因为一些蛋白酶抑制剂在某些条件下比其他蛋白酶抑制剂更稳定。通常,如果储备液按要求存储并且工作液即配即用,抑制剂仍具有足够的功能。一些蛋白酶抑制剂如PMSF非常不稳定,在裂解和纯化实验中为了确保蛋白酶被抑制需要多次添加该蛋白酶抑制剂。
一些公司销售用于检测蛋白酶功能的试剂,这些试剂可用于确认蛋白酶被充分抑制。Rochee销售一种通用蛋白酶底物(Universal Protease Substrate),它利用基于吸光度的分析来监测resorufin标记的酪蛋白的降解。如果有证据显示蛋白酶被不完全抑制,就可以用这个底物测试。其它公司如Calbiochem (EMD Millipore)销售一种相似的试剂。通常,如果蛋白酶仍可能有活性,那么直接配置新鲜的蛋白酶抑制剂溶液是一种省时省力的好方法。但是,如果蛋白水解是一个反复出现的问题,这些商业底物可以帮助使用者确定更合适的蛋白酶抑制条件。
蛋白酶抑制剂需加入细胞裂解液中,这样一旦细胞被裂解导致细胞内调控被破坏并且蛋白酶被释放出来,抑制剂就会立刻发挥作用。这些蛋白酶抑制剂应保留在纯化过程中早期缓冲液里,直到可以假定大多数杂质蛋白酶已与目标蛋白质充分分离。通常,如果色谱(例如亲和色谱法)的第一步是严格的,则仅需在该色谱方法洗涤步骤中加入蛋白酶抑制剂。洗脱缓冲液和剩下的纯化缓冲液通常不需要蛋白酶抑制剂。当大规模蛋白质纯化中需要大量缓冲液时,这是重要的成本考量。即使对资金充足的企业实验室,在大规模纯化中使用高浓度的蛋白酶抑制剂可能非常昂贵。但是,许多蛋白酶是非常高效的催化剂,具有高转换数,因此即使少量蛋白酶与目标蛋白共纯化也会产生问题。这个问题可能通过目标蛋白的明显降解(见图8)显现,或者直到质谱分析表明纯化的蛋白质含有许多不同种类的N末端而明显表现出来。对于许多应用如微异质性这可能不是问题,但对其它应用可能产生大问题。例如,在结构生物学里,这种N-末端异质性可能影响蛋白质的结晶能力和/或结晶的质量 [94-96] 。因此,在某些情况下可能需要将一种或多种蛋白酶的抑制剂应用在纯化方案的后期阶段。蛋白酶测试可以用于鉴定需要抑制的蛋白酶的种类。
细胞裂解和蛋白纯化可在低温下进行。通常裂解和纯化在℃下进行。这不仅有助于蛋白折叠,还能减缓杂质蛋白酶导致的水解反应。此外,杂质蛋白酶从目标蛋白质中清除地越快,它们与蛋白作用从而降解蛋白的时间就越短。即使在冰上,也不要将细胞裂解液放置过长时间。尽快进行纯化步骤并且妥善地保存纯化蛋白质。如果重组蛋白的水解是特别的问题,可以考虑的解决方法有很多。对于大肠杆菌表达,降低生长温度可能会降低细胞收集和裂解前发生的目标蛋白的水解 [97] 。通过将蛋白表达指向周质并因此减少蛋白与细胞内蛋白酶的接触,也可能减少目标蛋白在细胞内水解 [97, 98] 。类似地,为了避免细胞内哺乳动物蛋白酶的水解,可以使用驱动重组蛋白分泌到培养基中的表达系统 [99] 。考虑到不同生物体产生不同范围的蛋白酶,通过将表达转换到不同的宿主生物,还可以减少或甚至消除蛋白水解问题(例如大肠杆菌转到杆状病毒/昆虫细胞)。
在细胞裂解和蛋白质纯化过程中正确选择蛋白酶抑制剂组合的最佳入手点是尝试常用的蛋白酶抑制剂混合物。它们足以应付大多数细胞裂解物和许多其它应用。但是,如果无法获得完整蛋白或下游应用出现问题,可以使用单一蛋白酶抑制剂或蛋白酶抑制剂套装来确定蛋白酶抑制剂的最佳组合。
蛋白酶抑制剂用于各种临床试验中。特别是类胰蛋白酶抑制剂(TI)的几种结构亚型表现出对肺病的治疗前景。它们的作用机制包括活性结构域中丝氨酸残基的共价结合或结合天冬氨酸并形成氢键 [100] 。在动物模型中,基于苯磺酰胺的TI能有效地抑制过敏性肺部反应,如急性支气管痉挛 [101] 。含二肽的TI可有效降低哮喘介导的病理 [102] 和肝纤维化 [103] 。此外,胍基TI可作为溃疡性结肠炎的额外疗法 [104] 。此外,含β-内酰胺的TI可减少肺部炎症 [105].在心血管疾病方面,转化酶subtilsin-kexin 9型抑制剂可降低低密度脂蛋白,并被批准用于治疗严重高脂血症 [106] 。此外,二肽基肽酶-4(DPP-4)抑制剂可有效降低葡萄糖水平,并用于治疗2型糖尿病 [107] 。此外,在实验模型中DPP-4抑制剂linagliptin被证明可抑制糖尿病性视网膜病变的发展 [108] 。半胱氨酸蛋白酶组织蛋白酶K抑制剂可增加绝经后骨质疏松症患者的骨矿物质密度 [109] 。此外,组织蛋白酶K抑制剂odanacatib可降低骨质疏松症患者的骨吸收 [110] 。legend:肽键的水解。蛋白质水解是水分子参与的破坏连接各个氨基酸的羰基碳-氮单键的反应。虽然这种反应可以自发地发生 [2, 111] ,但是蛋白酶允许反应在更合理的符合生理过程的时间尺度上发生。legend: 丝氨酸蛋白酶水解肽键的机制。蛋白酶的活性位点含有一个丝氨酸、一个组氨酸和一个天冬氨酸残基。组氨酸残基能将丝氨酸羟基去质子化,从而使丝氨酸侧链成为亲核试剂。然后丝氨酸侧链对目标肽键的羰基碳形成亲核攻击。羰基双键重构,使丝氨酸蛋白酶活性位点的组氨酸残基去质子化,从而释放蛋白质的N-末端部分。然后一个水分子作为第二亲核试剂进攻丝氨酸连接的C-末端肽。一旦羰基双键重构,蛋白质的其余部分就从丝氨酸蛋白酶中释放出来,从而该酶可以与另一个底物结合。legend:天冬氨酸蛋白酶水解肽键的机制。天冬氨酸残基与水分子配位。一个天冬氨酸从水分子中去除一个质子,从而激活它对肽键的羰基碳进行亲核攻击。两种产物释放后,天冬氨酸蛋白酶可以结合另一个底物。legend:三种不同的商业蛋白酶抑制剂。PMSF是一个小分子,E-64是一个肽样分子,而aprotinin是一个小分子蛋白 [3] 。legend:与LP-130结合的HIV-1蛋白酶的晶体结构,一个过渡态抑制剂(10DY)。HIV-1是同源二聚体,每种单体提供天冬氨酸残基用来构成天冬氨酸蛋白酶的活性位点。绿色表示蛋白酶,黄色表示活性位点的天冬氨酸残基(D25来自每个单体)。红色表示被结合的抑制剂LP-130。图片由PyMol提供。legend:结合到胰蛋白酶的serpin的晶体结构(1K90)。绿色表示蛋白酶,红色表示抑制剂。黄色表示蛋白酶的活性位点残基,分别是His 63、Asp 107和Ser 200。在这个结构中丝氨酸突变为丙氨酸。图片由PyMol提供。legend:Roche cOmplete ULTRA片剂。这些片剂由适当浓度的多种蛋白酶抑制剂组成,以抑制生物样品中最丰富且最有问题的蛋白酶。来自Roche。legend:有/无Roche cOmplete ULTRA (无EDTA)蛋白酶抑制剂混合物片剂参与的蛋白质纯化。图片来自Roche并经过改动。
- Daniel Kahne, W. Clark Still (1988). Hydrolysis of a peptide bond in neutral water. Journal of the American Chemical Society 1988 110 (22), 7529-7534. 来自: dx.doi.org/10.1021/ja00230a041
- Martin, R. B. (1998), Free energies and equilibria of peptide bond hydrolysis and formation. Biopolymers, 45:351–353. 来自: dx.doi.org/10.1002/(SICI)1097-0282(19980415)45:5<351::AID-BIP3>3.0.CO;2-K
- Suzuki A, Tsutomi Y, Akahane K, Araki T, Miura M. Resistance to Fas-mediated apoptosis: activation of caspase 3 is regulated by cell cycle regulator p21WAF1 and IAP gene family ILP. Oncogene. 1998;17:931-9 pubmed
- LaCount D, Hanson S, Schneider C, Friesen P. Caspase inhibitor P35 and inhibitor of apoptosis Op-IAP block in vivo proteolytic activation of an effector caspase at different steps. J Biol Chem. 2000;275:15657-64 pubmed
- Datta R, Oki E, Endo K, Biedermann V, Ren J, Kufe D. XIAP regulates DNA damage-induced apoptosis downstream of caspase-9 cleavage. J Biol Chem. 2000;275:31733-8 pubmed
- MEROPS: the Peptidase Database. 来自: merops.sanger.ac.uk/index.shtml
- Hawkins C, Yoo S, Peterson E, Wang S, Vernooy S, Hay B. The Drosophila caspase DRONC cleaves following glutamate or aspartate and is regulated by DIAP1, HID, and GRIM. J Biol Chem. 2000;275:27084-93 pubmed
- Chabbat J, Porte P, Tellier M, Steinbuch M. Aprotinin is a competitive inhibitor of the factor VIIa-tissue factor complex. Thromb Res. 1993;71:205-15 pubmed
- Sperka T, Pitlik J, Bagossi P, Tozser J. Beta-lactam compounds as apparently uncompetitive inhibitors of HIV-1 protease. Bioorg Med Chem Lett. 2005;15:3086-90 pubmed
- Kuzmic P, Cregar L, Millis S, Goldman M. Mixed-type noncompetitive inhibition of anthrax lethal factor protease by aminoglycosides. FEBS J. 2006;273:3054-62 pubmed
- Govrin E, Levine A. Purification of active cysteine proteases by affinity chromatography with attached E-64 inhibitor. Protein Expr Purif. 1999;15:247-50 pubmed
- Roche Life Science. 来自: www.roche-applied-science.com/
- Chung Y, Troy H, Kristeleit R, Aherne W, Jackson L, Atadja P, et al. Noninvasive magnetic resonance spectroscopic pharmacodynamic markers of a novel histone deacetylase inhibitor, LAQ824, in human colon carcinoma cells and xenografts. Neoplasia. 2008;10:303-13 pubmed
- Zhou H, Yang H, Li Y, Wang Y, Yan L, Guo X, et al. Changes in Glial cell line-derived neurotrophic factor expression in the rostral and caudal stumps of the transected adult rat spinal cord. Neurochem Res. 2008;33:927-37 pubmed
- Park J, Kim G, Kim S, Ko J, Lee J, Yoo H. Effects of a chemical chaperone on genetic mutations in alpha-galactosidase A in Korean patients with Fabry disease. Exp Mol Med. 2009;41:1-7 pubmed
- Oshikawa M, Usami R, Kato S. Characterization of the arylsulfatase I (ARSI) gene preferentially expressed in the human retinal pigment epithelium cell line ARPE-19. Mol Vis. 2009;15:482-94 pubmed
- Petersen A, Carlsson T, Karlsson J, Jonhede S, Zetterberg M. Effects of dexamethasone on human lens epithelial cells in culture. Mol Vis. 2008;14:1344-52 pubmed
- Bonilha V, Rayborn M, Shadrach K, Li Y, Lundwall A, Malm J, et al. Semenogelins in the human retina: Differences in distribution and content between AMD and normal donor tissues. Exp Eye Res. 2008;86:150-6 pubmed
- Dey A, Seshasayee D, Noubade R, French D, Liu J, Chaurushiya M, et al. Loss of the tumor suppressor BAP1 causes myeloid transformation. Science. 2012;337:1541-6 pubmed
- Kraut D, Goff H, Pai R, Hosea N, Silman I, Sussman J, et al. Inactivation studies of acetylcholinesterase with phenylmethylsulfonyl fluoride. Mol Pharmacol. 2000;57:1243-8 pubmed
- Saario S, Savinainen J, Laitinen J, Jarvinen T, Niemi R. Monoglyceride lipase-like enzymatic activity is responsible for hydrolysis of 2-arachidonoylglycerol in rat cerebellar membranes. Biochem Pharmacol. 2004;67:1381-7 pubmed
- EMBL Protein Expression and Purification Core Facility. 来自: www.embl.de/pepcore/pepcore_services/index.html
- Scott M, Modha S, Rhodes A, Broadway N, Hardwicke P, Zhao H, et al. Efficient expression of secreted proteases via recombinant BacMam virus. Protein Expr Purif. 2007;52:104-16 pubmed
- Hopkins C, Czekaj M, Kaye S, Gao Z, Pribish J, Pauls H, et al. Design, synthesis, and biological activity of potent and selective inhibitors of mast cell tryptase. Bioorg Med Chem Lett. 2005;15:2734-7 pubmed
- Wright C, Havill A, Middleton S, Kashem M, Dripps D, Abraham W, et al. Inhibition of allergen-induced pulmonary responses by the selective tryptase inhibitor 1,5-bis-[4-[(3-carbamimidoyl-benzenesulfonylamino)-methyl]-phenoxy]-pen tane (AMG-126737). Biochem Pharmacol. 1999;58:1989-96 pubmed
- Levell J, Astles P, Eastwood P, Cairns J, Houille O, Aldous S, et al. Structure based design of 4-(3-aminomethylphenyl)piperidinyl-1-amides: novel, potent, selective, and orally bioavailable inhibitors of betaII tryptase. Bioorg Med Chem. 2005;13:2859-72 pubmed
- Tremaine W, Brzezinski A, Katz J, Wolf D, Fleming T, Mordenti J, et al. Treatment of mildly to moderately active ulcerative colitis with a tryptase inhibitor (APC 2059): an open-label pilot study. Aliment Pharmacol Ther. 2002;16:407-13 pubmed
- Sutton J, Bolton S, Hartl K, Huang M, Jacobs G, Meng W, et al. Synthesis and SAR of 4-carboxy-2-azetidinone mechanism-based tryptase inhibitors. Bioorg Med Chem Lett. 2002;12:3229-33 pubmed
- Inzucchi S, Bergenstal R, Buse J, Diamant M, Ferrannini E, Nauck M, et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2015;38:140-9 pubmed 出版商
- Daniel Kahne, W. Clark Still (1988). Hydrolysis of a peptide bond in neutral water. Journal of the American Chemical Society 1988 110 (22), 7529-7534. 来自: dx.doi.org/10.1021/ja00230a041
